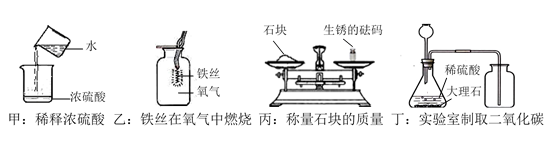



溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 8.6 | 11.6 | 10.3 | 11.1 |

已知滤液B中只含有一种溶质,则下列说法不正确的是( )

 B . 向等质量的Mg和Al中分别加入足量相同溶质质量分数的稀盐酸
B . 向等质量的Mg和Al中分别加入足量相同溶质质量分数的稀盐酸 C . 向等质量的Mg和MgO中分别加入足量相同溶质质量分数的稀硫酸
C . 向等质量的Mg和MgO中分别加入足量相同溶质质量分数的稀硫酸 D . 向一定质量的稀H2SO4和MgSO4的混合溶液中逐滴加入Ba(OH)2溶液
D . 向一定质量的稀H2SO4和MgSO4的混合溶液中逐滴加入Ba(OH)2溶液


高温X+Cu2O+CZn+2Cu+2CO2↑。则炉甘石主要成分X的化学式为。



【查阅资料】钠常温下就能与水发生剧烈反应,反应方程式为2Na+2H2O=2NaOH+H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如表所示:
实验编号 | 钠块大小 | 硫酸铜溶液 | 实验中产生沉淀的现象 |
① | 绿豆大小 | 稀溶液10毫升 | 产生蓝绿色沉淀 |
② | 绿豆大小 | 浓溶液10毫升 | 产生蓝色絮状沉淀 |
③ | 豌豆大小 | 稀溶液10毫升 | 产生蓝色絮状沉淀 |
④ | 豌豆大小 | 浓溶液10毫升 | 产生蓝色絮状沉淀,并出现黑色固体 |
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
a.上述实验中均未观察到色固体生成,由此判断猜想一错误。
b.实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
b.由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有。
c.为了用钠置换硫酸铜中的铜元素,小科设计了如下实验方案:
方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水硫酸铜直接混合,隔绝空气加热。
两个方案中,更合理的方案是,理由是。
Ⅰ.分别取少量混用,无明显现象,溶液无色透明,经测定混合溶液显酸性。由此可推断这两瓶溶液中的溶质一定不是;(填化学式,多填、少填、错填均不得分,下同)
Ⅱ.向上述混合溶液中加入Ba(NO3)2溶液,产生白色沉淀。则这两瓶溶液中的溶质至少是中的一种;
试推断这两瓶溶液的溶质可能的组合有种(填数字),请写出其中含阳离子种类最少的一种组合。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三:。
【查阅资料】氯化钙溶液呈中性。
【进行实验】实验步骤1:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象:结论:猜想一不正确
实验步骤2:取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量
实验现象:结论:猜想二不正确,猜想三正确
【反思与拓展】
⑴在分析化学反应后所得物质成分时,除考虑生成物外还需考虑。
⑵烧杯中的溶液未经处理直接倒入下水道,可能会使下水管道被腐蚀而损坏,要处理烧杯内溶液,使其溶质只含有CaCl2 , 应向烧杯中加入过量的。

第一次 | 第二次 | 第三次 | 第四次 | |
加入稀盐酸的质量(g) | 10 | 10 | 10 | 10 |
剩余固体的质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |

请解答:
