
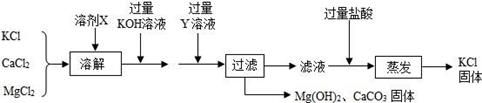
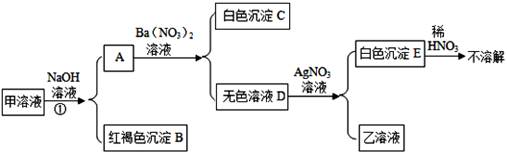
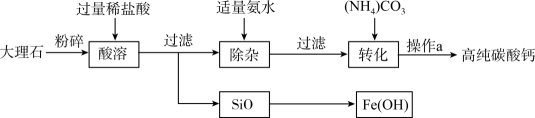


请你根据以上设计过程填空;

浸取时,需加足量的水并连续搅拌,使反应充分。请写出浸取时与NH4Cl反应的物质(填化学式)。生成的NH3可用石蕊试纸检验。

氢氧化物 | Fe(OH)3 | Al(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 2.3 | 4.0 | 开始溶解时的pH | 7.8 |
完全沉淀时的pH | 3.7 | 5.2 | 完全溶解时的pH | 10.8 |

根据流程回答问题:
(猜想与假设) 猜想 I:白色粉末是碳酸钠猜想 II:白色粉末是氢氧化钠
猜想 III:白色粉末是
(实验探究)取白色粉末溶于水形成溶液 A,设计如下实验:



已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。