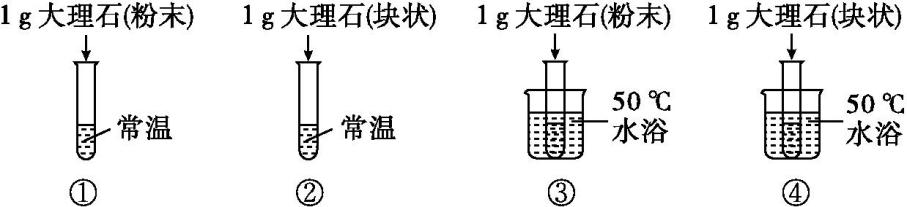
下列对比实验的设计不合理的是( )
选项 | 对比实验 | 探究影响因素 |
A | ①和② | 反应物的接触面 |
B | ②和③ | 温度 |
C | ②和④ | 温度 |
D | ③和④ | 反应物的接触面 |
选项 | 实验目的 | 实验操作 |
A | 除去CO2中少量的CO | 点燃 |
B | 除去CuSO 4溶液中的少量FeSO4 | 加入足量的铜粉 |
C | 鉴别二氧化碳和氮气 | 用燃着的木条 |
D | 鉴别硬水和软水 | 加入肥皂水 |
实验 目的 | 测定空气中氧气的含量 | 探究燃烧需要氧气 | 验证质量守恒定律 | 探究石墨的导电性 |
实验 设计 |
|
|
|
|
选项 | A | B | C | D |
| 选项 | A | B | C | D |
| 实验信息 | | | | |
| 分析结论 | 分析说明MnO2是过氧化氢分解的催化剂 | 说明氧分子运动速率与温度有关 | 说明温度越高,分子运动越快 | 该实验可用于辨识硬水和软水 |
 探究
探究 验证质量守恒定律
C .
验证质量守恒定律
C .  验证二氧化碳与水反应生成碳酸
D .
验证二氧化碳与水反应生成碳酸
D .  验证可燃物燃烧需要温度达到着火点
验证可燃物燃烧需要温度达到着火点
 B . 证明二氧化碳能溶于水
B . 证明二氧化碳能溶于水 C . 比较CaCO3与HCl及H2SO4反应的速率
C . 比较CaCO3与HCl及H2SO4反应的速率 D . 此装置具有“控制反应发生和停止”的功能
D . 此装置具有“控制反应发生和停止”的功能
| 实验操作 | 现象 | 结论 |
A | 在带尖嘴的导管口点燃某气体,然后在火焰上方罩一冷而干燥的小烧杯 | 烧杯内壁有水雾 | 该气体不一定是H2 |
B | 把硫在空气中点燃,再伸进充满氧气的集气瓶里 | 硫在空气中燃烧发出淡蓝色火焰,在氧气中燃烧发出蓝紫色火焰 | 硫在空气中燃烧生成SO2 , 在氧气中燃烧生成SO3 |
C | 将用石蕊溶液染成紫色的湿润的纸花放入盛满二氧化碳的集气瓶中 | 纸花变为红色 | 使石蕊变红的物质为二氧化碳 |
D | 称量铜粉在空气中加热前后的质量 | 加热后的质量比原来铜粉的质量大 | 该化学反应不遵循质量守恒定律 |
选项 | 实验目的 | 实验方案 |
A | 除去碳酸钙中少量的氧化钙固体 | 把样品加足量的水溶解后过滤、洗涤、干燥 |
B | 区分铁粉和二氧化锰粉末 | 可观察颜色 |
C | 鉴别一氧化碳和二氧化碳 | 通入澄清石灰水,观察是否有沉淀 |
D | 检验水样是否为软水 | 取样,加入肥皂水,振荡,看是否有大量泡沫 |
选项 | 实验目的 | 实验方案 |
A | 除去铜粉中少量碳粉 | 在空气中充分灼烧 |
B | 除去氧气中少量氢气 | 将混合气体点燃 |
C | 探究某可燃性气体是否含有氧元素 | 点燃可燃性气体,在火焰上方罩一个冷而干燥的烧杯,观察是否有水雾 |
D | 检验碳酸钙高温分解是否完全 | 取少量固体加入足量稀盐酸,观察是否有气泡产生 |
图像 |
|
|
|
|
实验设计 | 将一定量的氯酸钾和二氧化锰混合固体加热 | 向一定量锌粉和铜粉的混合固体中加入足量硫酸铜溶液 | 向一定量的生石灰中,加入200mL水 | 足量红磷在密闭实验的集气瓶中燃烧 |
 验证反应放热
B .
验证反应放热
B .  比较空气与人体呼出的气体中CO2的含量
C .
比较空气与人体呼出的气体中CO2的含量
C .  验证质量守恒定律
D .
验证质量守恒定律
D .  探究铁生锈的条件之一:与氧气接触
探究铁生锈的条件之一:与氧气接触
选项 | 实验 | 现象 | 结论 |
A |
| 铜片上的白磷燃烧,铜片上的红磷和水中的白磷都不燃烧 | ①说明燃烧的条件—温度达到可燃物的着火点、接触空气②说明白磷的着火点比红磷低 |
B |
| 塑料瓶变瘪 | ①说明二氧化碳能溶于水②说明二氧化碳能与水反应 |
C |
| 玻璃管中出现红色固体,澄清石灰水变浑浊 | ①说明一氧化碳具有还原性②说明一氧化碳能与氢氧化钙溶液反应 |
D |
| 酚酞溶液变红 | ①说明分子在不停地运动②说明氨水显酸性 |
实验 |
铁燃烧实验 |
除去粗盐中的泥沙 |
测定空气中氧气的含量 |
检验实验室制出的二氧化碳 |
异常情况 | 实验没有看到上述火星四射现象 | 滤液浑浊 | 测定结果偏大 | 澄清石灰水没有变浑浊 |
选项 | A.可能是收集的氧气不纯且浓度太低 | B.可能是滤纸破损 | C.可能是红磷的量不足 | D.可能是二氧化碳中混有氯化氢气体 |



实验操作 | 实验现象 | 实验结论 |
实验操作 | 现象 | 结论或化学方程式 |
取少量该样品,滴加足量的某溶液,充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 |
在滤液中滴加酚酞溶液 | 样品未完全变质,仍含有氢氧化钠 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①向充满二氧化碳的软塑料瓶中注入约 | ||
| ②继续向瓶中滴加紫色石蕊溶液,振荡 | 二氧化碳能与水反应 |
[任务三]制定低碳行动方案
通过该项目的探究,小组同学对低碳行动有了新的认识,请补充完整。
低碳途径 | 低碳行动具体措施(任写一条) |
减少二氧化碳的排放 | |
促进二氧化碳的吸收 | 植树造林 |
二氧化碳的转化和封存 |
愉快的项目之旅结束了,同学们决定立刻行动起来,助力“双碳”目标早日实现!

实验现象 | 实验结论 |
试管内壁有水雾 | 铜绿加热后产生(1) (物质符号) |
固体从绿色变为(2) | 铜绿加热后生成氧化铜 |
气球胀大 |

【发现问题】气球为什么会胀大?
【提出猜想】
猜想I:试管内的空气受热膨胀使气球胀大;
猜想Ⅱ:铜绿加热产生氦气使气球胀大;
猜想Ⅲ:铜绿加热产生二氧化碳使气球胀大;
猜想IV:铜绿加热产生一氧化碳气体使气球胀大。
【实验分析】①根据质量守恒定律,可立即判断猜想不成立:
②熄灭酒精灯后,气球稍微缩小但没有缩小到加热前的大小,证明猜想不成立.
③乙同学用下图装置进行实验,观察到,说明铜绿加热后有CO2产生,产生该现象的化学方程式是,同时还观察到
说明猜想IV不成立。

【实验反思】加热铜绿反应的化学方程式是
锰钢(含Fe、Mn、C等)是具有优良金属性能的合金,在生产生活中有广泛的应用。
查阅文献得知:①金属锰是难溶于水的灰白色固体。
②金属锰在水溶液中反应通常显价,使溶液呈肉色。
③锰钢板中锰元素的含量一般在11%至14%之间。
兴趣小组同学为了解Mn、Fe、Cu三种金属的活动性顺序,进行了如下探究。
猜想I:;
猜想Ⅱ:;
猜想Ⅲ:。
实验序号 | 操作 | 现象 | 结论 |
1 | 将三种打磨好,粗细质量相同的金属片,分别放入相同的稀硫酸中 | 放入铁片溶液呈绿色,放入锰片溶液为肉色,放入铜片溶液为无色 | 猜想错误 |
2 | 将打磨好的锰片放入硫酸亚铁溶液中 | 猜想I正确 |
有同学认为实验1除了颜色的变化还应该有其他实验现象,理由是(任选一个,用化学方程式解释)。
为更好地探究过量的硫酸与等质量的铁和锰反应实验(如下图所示),气球膨胀速度较快的是(选填“Mn”或“Fe”),产生气体质量较大的是(选填“Mn”或“Fe”)。

实验编号 | 盐酸的浓度 (均取20mL) | 金属 (均取2g) | 金属的形状 | 收集50mL氢气所需时间/s |
① | 10% | 铝 | 粉状 | 70 |
② | 10% | 铁 | 片状 | 120 |
③ | 10% | 铝 | 片状 | 112 |
④ | 20% | 铁 | 片状 | 110 |
①金属与酸反应的接触面积;②。