选项 | 劳动项目 | 化学知识 |
A | 家务劳动:用洁厕灵(主要含浓盐酸)清洗马桶 | 含氯化合物具有杀菌消毒功能 |
B | 学农活动:用厨余垃圾制肥料 | 厨余垃圾含N、P、K等元素 |
C | 志愿者服务:“厨房废油制肥皂”爱心暑托班活动 | 皂化反应 |
D | 自主探究:果蔬电池 | 原电池原理 |
|
选项 |
实验操作 |
现象 |
结论 |
|
A |
取5 mL0.11 mol·L-1KI 溶液于试管中,加入1 mL0.1 mol·L-1FeCl3溶液,充分反应后滴入5滴15%KSCN溶液 |
溶液变血红色 |
KI与FeCl3的反应有一定限度 |
|
B |
向溶液X中滴加少量NaOH稀溶液,将湿润的红色石蕊试纸靠近试管口 |
石蕊试纸不变蓝 |
溶液X中肯定不含 |
|
C |
将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 |
溶液变黄色 |
氧化性:H2O2> Fe3+ (酸性条件) |
|
D |
向一定浓度的CuSO4溶液中通入适量H2S气体 |
产生黑色沉淀 |
H2S的酸性比H2SO4的强 |

编号 | 表面积/ | 0min | 20min | 40min | 60min | 80min |
① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
② | a | 1.20 | 0.80 | 0.40 | x | |
③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
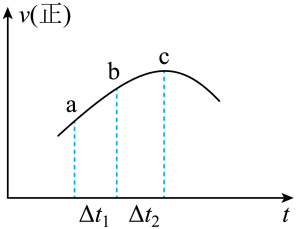
①反应在c点达到反应进行的限度
②浓度:a点小于c点
③逆反应速率图像在此时间段内和图中趋势相同
④ , ab段
的消耗量小于bc段
的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
Ⅰ对于4FeS2+11O2═2Fe2O3+8SO2 , 试回答有关的问题:
(1)常选用哪些物质浓度的变化来表示该反应的速率
(2)为了提高生成SO2的速率,可以采取的措施是
A.增加FeS2的量 B.增大O2的浓度 C.升高温度 D.减小压强
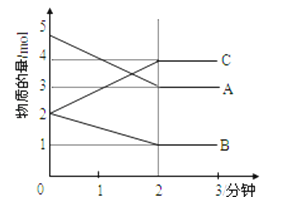
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
(3)该反应的化学方程式为
(4)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2:1:2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化.
请回答下列问题:

②假设只生成NO2 , 通过计算理论上收集到的气体体积为mL (标准状况下).
③实验最终测得气体的体积为130.5mL(标准状况下),与理论值有差异,其理由可能为.
A.Cu与一定物质的量浓度的HNO3反反应除了生成NO2还生成NO
B.过程中还发生了反应4NO+3O2+2H2O=4HNO3
C.过程中还发生了反应4NO2+O2+2H2O=4HNO3
D.硝酸具有挥发性,对实验有影响.
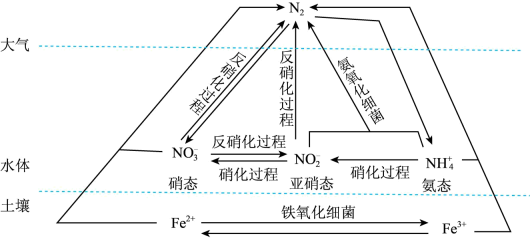
①酸性条件下,脱除水体中硝态氮(NH4+)的原理为
, 该反应中氧化产物与还原产物的物质的量之比为。
②酸性条件下,脱除水体中硝态氮(
)生成
的离子方程式为。

①作负极的物质是。
②正极的电极反应式是。
|
初始pH |
pH=2.5 |
pH=4.5 |
|
NO3-的去除率 |
接近100% |
<50% |
|
24小时pH |
接近中性 |
接近中性 |
|
铁的最终物质形态 |
| |
pH=4.5时,NO3-的去除率低。其原因是。
|
初始pH |
pH=2.5 |
pH=4.5 |
|
NO3-的去除率 |
约10% |
约3% |
|
1小时pH |
接近中性 |
接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:。