①野火烧不尽,春风吹又生;②春蚕到死丝方尽,蜡炬成灰泪始干;③千锤万凿出深山,烈火焚烧若等闲;④爆竹声中一岁除,春风送暖入屠苏;⑤只要功夫深,铁杵磨成针;⑥火树银花;⑦死灰复燃;⑧凿壁借光。




 反应
反应 已知:2CO(g)+O2(g) = 2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g) = H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g) = CH3OH(g) △H3=-107kJ.molˉ1
则CH3OH(g)+O2(g) = CO2(g)+2H2O(g) △H=kJ·molˉ1
在25℃、101 kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+ OH─(aq)= H2O(l) △H=-57.3 kJ·mol−1。按照下图所示装置进行实验。

仪器A的名称是。
|
实验序号 |
A溶液 |
B溶液 |
|
① |
30 mL 0.1 mol·L-1 H2C2O4溶液 |
20 mL 0.01 mol.L-1 KMnO4溶液 |
|
② |
30 mL 0.2 mol·L-1 H2C2O4溶液 |
20 mL 0.01 mol.L-1 KMnO4溶液 |

若反应均未结束,则相同时间内针筒中所得CO2的体积大小关系是(填实验序号)。
I.2CO2(g)+6H2(g) C2H4(g)+4H2O(g)ΔH1
II.CO2(g)+H2(g) CO(g)+H2O(g)ΔH2>0
请回答下列问题:

①下列说法正确的是
A.由图1可知:0.1MPa下,200℃~550℃时以反应I为主,550℃以后以反应II为主
B.反应II化学方程式前后物质的化学计量数之和相等,所以反应II的ΔS等于零
C.恒温恒压下,容器内气体的密度不变时,说明反应已达平衡
D.其他条件不变,将CO2和H2的初始物质的量比改变为2:3,可提高CO2平衡转化率
②图1中点M(350,70)、此时乙烯的选择性为 (选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =。
③在图1中,温度大于800℃时,随着压强的增大,CO2的平衡转化率减小,请解释原因。
i CO2(g)+H2(g) CO(g)+H2O(g)慢
ii 2CO(g)+4H2(g) C2H4 (g)+2H2O(g)快
在图2中画出反应I分两步进行的“能量−反应过程图”。起点从[2CO2(g)+6H2(g)]开始。

已知:CH4(g)=C(s)+2H2(g) △H=+75.0kJ•mol-1
C(s)+O2(g)=CO2(g) △H=-394.5kJ•mol-1
C(s)+ O2(g)=CO(g) △H=-110.5kJ•mol-1
则催化重整反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的△H=kJ•mol-l;从温度和压强的角度考虑,有利于提高CH4平衡转化率的条件是。
反应A:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=-124.2kJ•mol-1
已知: 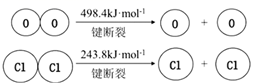
①断开1molH—O键与断开1molH—Cl键所需能量相差为 kJ。
②新型RuO2催化剂对反应A有很好的催化活性。加入催化剂后,该反应的△H(填“变大”、“变小”或“不变”)。
C (s) +O2 (g) =CO2 (g) △H=-393.5 kJ·mol-1
2C (s) +O2(g) =2CO (g) △H=-221 kJ·mol-1
若某反应的平衡常数表达式为:K= ,请写出此反应的热化学方程式,该反应(填高温、低温)能自发进行。

①温度:T1T2(填“<”或“>”)。
②某温度下,若反应进行到10分钟达到平衡状态D点时,容器的体积为2L,则此时的平衡常数K=L/mol(保留两位有效数字);用CO的浓度变化表示的平均反应速率(CO)=。
③若在D点对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中的点。
a.NO2和O2的浓度比保持不变 b.容器中压强不再变化
c.2V正(NO2)=V逆(N2O5) d.气体的密度保持不变