
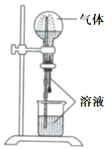
| ①中的物质 | ②中的物质 | 预测①中现象 | |
| A | 淀粉碘化钾溶液 | 浓硝酸 | 无明显现象 |
| B | 酚酞溶液 | 浓盐酸 | 无明显现象 |
| C | 氯化铝溶液 | 浓氨水 | 有白色沉淀 |
| D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |

![]()

|
气体 |
溶液 |
|
|
A. |
H2S |
稀盐酸 |
|
B. |
HCl |
稀氨水 |
|
C. |
NO |
稀H2SO4 |
|
D. |
CO2 |
饱和NaHCO3溶液 |


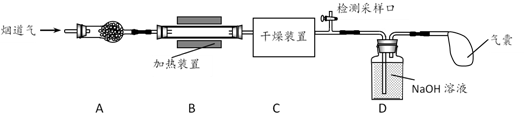
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4·5H2O)
①若反应后尾气无残留,则参加反应的NO2、NO物质的量比值为(填字母)。
a.≥1 b.≤1 c.任意值
②可使用适量酸性H2O2溶液,将溶液中的NO2-全部氧化为NO3- , 发生反应的离子方程式是。
步骤一、取适量(2)中H2O2处理后的溶液,调节pH至中性,蒸发浓缩,得到c(NO3-)为0.100mol·L-1的溶液甲。
步骤二、现量取50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中对溶液乙进行氮脱除。
步骤三、重复实验2~3次,溶液中NO3-的残留情况与反应时间的关系如图所示。

①金属铝和金属铁在0~3h内,NO3-的脱除效率均很低,几乎没被脱除,其可能的原因是。
②0~3h内铝铁合金的氮脱除效率比金属铝、金属铁大得多,其可能的原因。

已知生成氢氧化物沉淀的pH如下表所示:
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀 | 4.2 | 6.5 | 1.5 |
| 完全沉淀 | 6.7 | 9.7 | 3.7 |

a.烧碱
b.二氧化锰
c.生石灰
d.氯化铵
|
N2 |
O2 |
Ar |
CO2 |
|
-196℃ |
-183℃ |
-186℃ |
-78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是。
①制取氨气的化学方程式为;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为g。
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
①NH3与稀硫酸溶液反应的离子方程式为;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是。
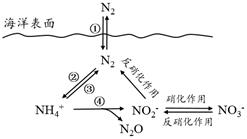
a. 海洋中存在游离态的氮
b. 海洋中的氮循环起始于氮的氧化
c. 海洋中的反硝化作用一定有氧气的参与
d. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
|
温度/℃ |
样本氨氮含量/mg[ |
处理24h |
处理48h |
|
氨氮含量/mg |
氨氮含量/mg |
||
|
20 |
1008 |
838 |
788 |
|
25 |
1008 |
757 |
468 |
|
30 |
1008 |
798 |
600 |
|
40 |
1008 |
977 |
910 |
硝化细菌去除氨氮的最佳反应温度是,在最佳反应温度时,48 h内去除氨氮反应的平均速率是mg·L-1·h-1。
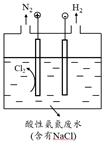
①阳极的电极反应式:;
②写出电解产物氧化去除氨氮的离子方程式:;
③若生成H2和N2的物质的量之比为3:1,则处理后废水的c(H+)将(填“增大”、“不变”或“减小”)。
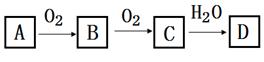
①D的化学式是;
②在工业生产中,B气体的大量排放被雨水吸收后形成了而污染了环境。
①A、C的化学式分别是:A;C 。
②请写出C→D的反应化学方程式 。该反应与中,氧化剂与还原剂的物质的量之比为。