
 B .
B .  D .
D . 
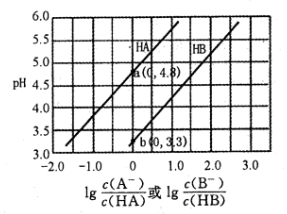
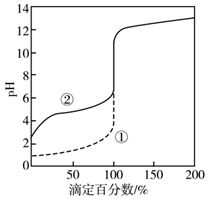


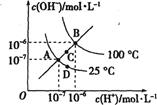
下列说法正确的是( )





实验i 测定平衡体系中I2和I 总浓度

实验ii 测定饱和碘水中I2浓度

已知: 。


①实验中,使淀粉碘化钾试纸变蓝的物质是,而后碘被(填“氧化”或“还原”)导致蓝色褪去。
②对比实验Ⅰ和Ⅱ的现象可以说明乙醇被NaClO氧化,理由是。
③实验过程,测得实验Ⅰ中混合溶液的pH由12.38逐渐增大至12.80,说明乙醇与NaClO反应可能生成。
①滴定前,将锥形瓶置于“冷暗处”的目的是,写出NaClO与KI反应的离子方程式。
②滴定终点溶液的颜色是,84消毒液与医用酒精1:1反应后溶液中NaClO的质量分数=(结果保留3位有效数字;I2+2S2O =2I-+S4O
)。

已知:2NaClO + (CNO)3H3 = (CNO)3Cl2Na + NaOH + H2O
回答下列问题:
反应原理: [(CNO)3Cl2]-+ H+ +2H2O = (CNO)3H3
+ 2HClO, HClO
+ 2I- + H+ = I2 + Cl-+ H2O, I2 + 2S2O = S4O
+ 2I-
实验步骤:准确称取m g样品,用容量瓶配成250 mL溶液;取25.00 mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用 c mol/L Na2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为 V mL。
①滴定终点现象为。
②该样品的有效氯含量表达式为 。(该样品的有效氯= ×100%)
|
甘氨酸(H2NCH2COOH) |
柠檬酸 |
甘氨酸亚铁 |
|
易溶于水,微溶于乙醇,两性化合物 |
易溶于水和乙醇,有酸性和还原性 |
易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中缓慢加入200mL1.1mol•L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe:实验装置如图(夹持和加热仪器已省略),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。

回答下列问题:
②A中反应产生的气体是,C中空气排净时,D中现象是。
③洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是(填标号)。
a.乙醇 b.热水 c.柠檬酸溶液
①称量6.0g甘氨酸亚铁样品,将其全部溶于稀H2SO4中,配制成250mL溶液。取10.00mL配制好的溶液于锥形瓶中,用0.10mol•L-1的Ce(SO4)2溶液滴定,以邻二氮菲为指示剂。当溶液由红色变为浅蓝色且半分钟之内不恢复原色,滴定达到终点。若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率(填“偏高”“偏低”或“不变”)
②滴定时消耗9.60mLCe(SO4)2溶液,则甘氨酸亚铁样品中Fe2+的氧化率为。


①由图-1,乙醇氧化过程中存在中间产物,该中间产物的化学式为。
②由图-2,随温度升高,x(CO)峰值出现的时间提前,且峰值更高,其可能的原因是。

一定浓度的过氧化氢,随pH增大分解率增大的原因是。
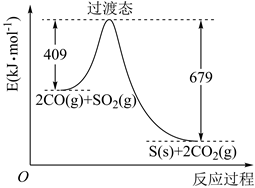
a.若混合气体密度保持不变,则已达到平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量CO2 , 平衡常数保持不变
d.分离出少量S粉,正、逆反应速率均保持不变