
反应①:CH4(g)+CO2(g)⇌2CO(g)+2H2(g)ΔH1=+247.4kJ·mol-1
反应②:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
反应③:CH4(g)+ O2(g)⇌CO(g)+2H2(g)ΔH3=-35.6kJ·mol-1
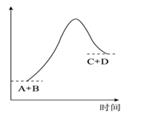
一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0mol及少量O2 , 测得不同温度下反应平衡时各产物产量如图所示,下列说法正确的是( )

| 化学键 | N—H | N—Cl | H—Cl |
| 键能(kJ/mol) | 391.3 | x | 431.8 |


已知:2CO(g)+O2(g) = 2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g) = H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g) = CH3OH(g) △H3=-107kJ.molˉ1
则CH3OH(g)+O2(g) = CO2(g)+2H2O(g) △H=kJ·molˉ1

在锌与稀盐酸的反应中,
(填“>”或“<”或“=”)
| 化学键 | | | | | |
| | 436 | 343 | 1076 | 465 | 413 |
则 生成
放出
热量。

a.用量筒量取
盐酸倒入如图装置的小烧杯中,测出盐酸温度。
b.用另一量筒量取
溶液,并用另一温度计测出其温度。
c.将 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
①实验中,倒入 溶液的正确操作是。
A.一次性快速倒入 B.分3次倒入 C.边搅拌边慢慢倒入
②若将各含 溶质的
稀溶液、
稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为
、
、
,则
、
、
的关系为。
①负极的电极反应式为。
②当消耗甲烷11.2L(标准状况下时),则导线中转移的电子的物质的量为 。
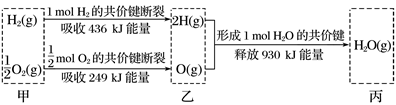
①H2(g)+ O2(g)=H2O(l) ΔH=-285.8kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
③CO(g)=C(s)+ O2(g) ΔH=+110.5kJ·mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
回答下列问题:
P(s,红磷)+ O2(g)=
P4O10(s) ΔH=-738.5kJ·mol-1
写出白磷转化为红磷的热化学方程式:。