| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 1 | 20 | 15 | 2 |
| 反应后质量/g | m | 29 | 0 | 8 |

 B .
B .  C .
C .  D .
D . 

| 选项 | 用途 | 化学原理(用化学方程式表示) | 基本反应类型 |
| A | 高炉炼铁 | 3CO+2Fe2O3 | 置换反应 |
| B | 稀盐酸用于除铁锈 | Fe2O3+2HCl=FeCl2+2H2O | 化合反应 |
| C | 用熟石灰处理硫酸厂废液 | Ca(OH)2+H2SO4=CaSO4+2H2O | 复分解反应 |
| D | 电解水制氢气 | 2H2O=2H2+O2 | 分解反应 |



A.它是金属材料 B.它是一种化合物 C.它是一种混合物




|
实验次序 |
第一次 |
第二次 |
第三次 |
第四次 |
|
加入稀硫酸的质量(克) |
35 |
35 |
35 |
35 |
|
剩余固体的质量(克) |
8.6 |
7.4 |
6.2 |
5.2 |
|
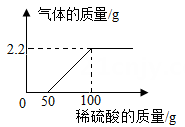
实验次数 |
1 |
3 |
4 |
5 |
6 |
|
取样品质量(g) |
31.0 |
31.0 |
31.0 |
31.0 |
31.0 |
|
取稀硫酸质量(g) |
30.0 |
90.0 |
120.0 |
150.0 |
180.0 |
|
产生气体质量(g) |
0 |
a |
0.3 |
0.5 |
0.6 |
①小苏打治疗胃酸过多 ②熟石灰改良酸性土壤 ③硫酸与火碱反应

【实验步骤】①检查装置的气密性;②精确称量镁在空气中燃烧后的固体5.00g放入锥形瓶中,称量装置C,连接好装置;③关闭活塞K,打开A中分液斗活塞,逐滴加入水,至样品恰好完全反应;④打开活塞K,鼓入空气;⑤再次称量装置C,装置C增重0.34g。
请回答:
(一)实验步骤④中鼓入空气的目的是;
(二)体混合物中Mg3N2的质量分数为;
(三)实验证明此方法测定的结果偏低,可能原因是(写一条)。
【提出问题】Cu块与什么物质发生了化学反应,产生的气体是H2吗?
小军同学认为产生的气体一定不是H2 , 你认为他作出此判断的合理理由是
【查阅资料】NO是一种无色气体,与空气接触后生成红棕色的NO2气体。请写出此气体颜色发生变化的化学方程式。
【提出猜想】
猜想一:Cu块与KNO3溶液发生了化学反应;
猜想二:Cu块与K2SO4溶液发生了化学反应;
猜想三:Cu块与溶液发生了化学反应。
【没计实验】
|
实验步骤 |
实验现象 |
解释或结论 |
|
①将Cu块加入KNO3溶液中 |
Cu块不溶解 |
说明猜想一是错误的 |
|
②将Cu块加入到K2SO4溶液中 |
Cu块不溶解 |
说明猜想二是错误的 |
|
③将Cu块加入到稀HNO3溶液中 |
Cu块溶解,有无色气体产生,该气体与空气接触后变成红棕色的气体,溶液变成蓝色 |
说明猜想三是正确的 |
【实验结论】猜想三成立。请写出Cu块加入到稀HNO3溶液中发生反应的化学方程式。
实验步骤:

步骤一:用图甲所示装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,另外带火星的木条复燃。
步骤二:将反应后试管中的固体加水充分溶解、过滤、洗涤,向滤渣中加入足量稀硫酸, 发现固体全部溶解,得到蓝色溶液。
步骤三:在图甲的试管和集气瓶之间连上图乙所示的装置,重新进行加热硝酸铜的实验, 发现集气瓶中气体呈无色,也能使带火星的木条复燃。
查阅资料:
①NO2是红棕色、有刺激性气味的气体;
②在相同状况下,气体的体积比等于其分子个数比。请回答:

碱式碳酸铜和碱式氯化铜分别属于无害锈和有害锈,解释原因: 。

①装置丙的作用是 。
②实验前、后均需对装置甲、乙、丙进行称重;当装置甲中固体质量不再减少,对装置甲、乙、丙进行再次称重前,需打开活塞再次通入足量的N2 , 其目的是 。
③若碱式碳酸铜的化学式为Cu2(OH)2CO3 , 则装置乙将增重 克。