 B .
B .  C .
C .  D .
D . 


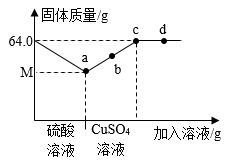
①“金(即钢)柔锡柔,合两柔则刚。”
②何意百炼钢,化为绕指柔(“百炼钢”指生铁经过高温煅烧,反复锤炼成为钢)。
③东晋《抱朴子》中记载:“以曾青涂铁 , 铁赤色如铜”(“曾青”即硫酸铜溶液)。
④美人首饰侯王印,尽是沙中浪底来(“首饰”、“印”指金制品)。
①~④划线部分,发生置换反应的化学方程式为;①说明合金与组成它的纯金属相比,具有的优点是。

滤液的成分中一定含有的溶质是(填化学式);滤液质量原混合溶液(填“>”、“<”或“=”)。


①步骤I中反应的化学方程式是。
②除水、AgNO3外,滤液C中还有。(填化学式)
③若经过步骤Ⅳ后得到了43.2g的Ag,则a=。
④如果将步骤I中的Cu原子换成同样个数的Fe原子,则最后得到的Ag的质量(填“会”或“不会”)改变,因为。

猜想一:Al>Cu>R,猜想二:,猜想三:R>Al>Cu。
|
猜想 |
主要操作 |
主要现象 |
实验结论 |
|
一 |
打磨R丝,并将其插入到硫酸铜溶液中 |
R丝表面覆盖了一层红色的物质 |
猜想一 (“成立”或“不成立”) |
|
二 |
打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中 |
①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色 ②铝丝表面产生气泡较快 ③铜丝表面没有气泡产生 |
猜想二成立 |
|
三 |
把铝丝插入RSO4溶液中 |
|
猜想三成立 |

①Cu、ZnSO4溶液、Ag
②Zn、Cu、Ag、稀硫酸
③Ag、Zn、CuSO4溶液
④稀硫酸、Zn、Cu、AgNO3溶液
⑤ZnSO4溶液、Cu、AgNO3溶液

实验中观察到,甲中铝丝表面附着一层色固体,乙中溶液颜色变为色。
你认为通过上述实验(填“能”或“不能”)得出三种金属的活动性强弱。
小明同学将Al丝浸入硫酸铜(CuSO4)溶液中没有发现任何现象。纠其原因是没有对铝丝进行打磨,用化学方程式表示铝表面形成的氧化膜。
|
操作 |
现象 |
结论 |
分析 |
|
向一支试管中再加入NaCl固体 |
铝丝表面有固体析出 |
氧化铝薄膜被破坏 |
Na+或能破坏氧化铝薄膜 |
|
向另一支试管中再加入Na2SO4固体 |
|
氧化铝薄膜未被破坏 |
Na+和 |
(得出结论)
前述猜测正确
(总结反思)
本次探究充分运用了比较法和控制变量法。