Ⅰ.共价键的键能是指形成1mol某种共价键的过程中所放出的能量或断裂1mol某种共价键的过程中所吸收的能量。显然共价键的键能越大,该共价键越牢固,含有该共价键的分子越稳定。如H—H键的键能是436kJ·mol-1 , 是指使1molH2分子变成2molH原子需要吸收436kJ能量。
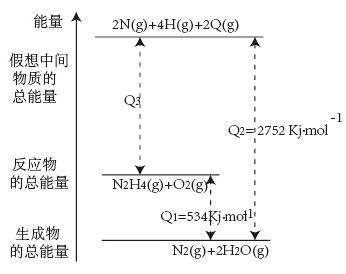
1molN2H4(g)和1molO2(g)生成2molN原子、4molH原子、2molO原子的过程中(填“吸收”或“放出”)kJ能量。
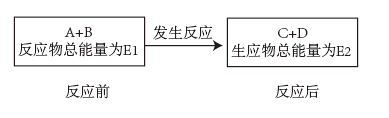
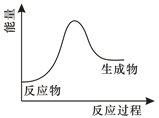
若E1>E2 , 则该反应为(填“放热反应”或“吸热反应”)。
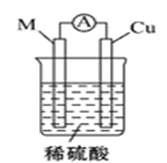
方案一:取5mL0.1mol/LKI溶液,滴加2mL0.1mol/L的FeCl3济液,滴入5滴稀盐酸,再继续加入2mLCCl4 , 充分振荡、静置、分层,取上层清液,滴加KSCN溶液,现象是,即可证明该反应为可逆反应。你认为此方案(“不严密”或“严密”),理由是(用离子方程式表示)。
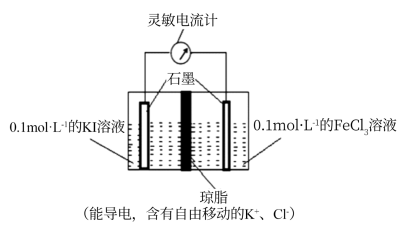
方案二:设计如图原电池装置,接通灵敏电流计,指针向右偏转,随着反应时间进行;电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右边的池了中加入1mol/L FeCl2溶液,灵敏电流计指针向左偏转,即可证明该反应为可逆反应。你认为灵敏电流计“读数变为零”的原因是。
| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CH3OH)(mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
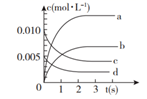
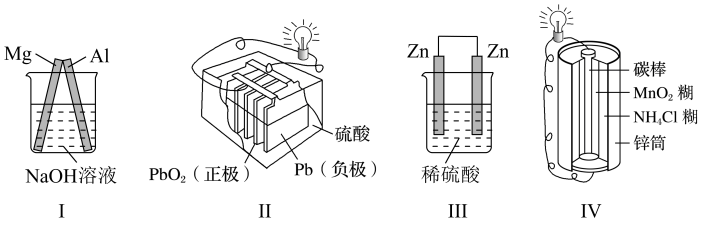
则电池放电时通入空气的电极为(“正”或“负”)极;从电极反应来看,每消耗1 mol CH3OH转移mol电子。
|
实验 编号 |
室温下,试管中所加试剂及其用量/mL |
室温下溶液颜色褪至无色所需时间/min |
|||
|
0.6mol·L-1H2C2O4溶液 |
H2O |
0.2mol·L-1KMnO4溶液 |
3mol·L-1稀硫酸 |
||
|
1 |
3.0 |
4.0 |
1.0 |
2.0 |
6.4 |
|
2 |
3.0 |
3.0 |
2.0 |
2.0 |
5.2 |
|
3 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
请回答:
一定能判断该反应达到化学平衡状态的是_______。
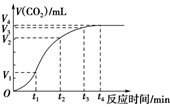
A.0~t1 B.t1~t2 C.t2~t3 D.t3~t4