

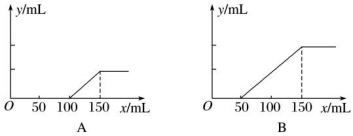
在 A 情况下,溶质是(填化学式) ,其物质的量之比为。
①定容时俯视刻度线。
②转移前,容量瓶内有蒸馏水。
③定容时水加多了用胶头滴管吸出。
①将碱式滴定管用蒸馏水洗净,并用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,从碱式滴定管中放入20. 00mL待测溶液到锥形瓶中
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0. 1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数
③向锥形瓶中滴入酚酞作指示剂,进行滴定. 滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL
试回答下列问题

|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20. 00 |
0. 50 |
25. 40 |
|
第二次 |
20. 00 |
4. 00 |
29. 10 |
请计算待测NaOH溶液的浓度为
A 未用标准液润洗酸式滴定管
B 滴定终点读数时,俯视滴定管的刻度,其它操作均符合题意
C 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E 溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液无变化

①写出甲中发生反应的离子方程式:。
②乙中盛的试剂是;作用是。丙中盛的试剂是。
①上述反应中是氧化剂,该反应中氧化产物与还原产物的物质的量之比为。
②把氯气通入紫色石蕊溶液中,可以观察到的现象是:。
③实验室配制好2.0mol·L-1的NaOH溶液,需要这种溶液mL才能与3.36L氯气(标准状况)恰好完全反应。
④若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变色,其离子方程式是:,向所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层是显色,这种操作叫做
①配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)。
a.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
b.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
c.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
d.将容量瓶盖紧,振荡,摇匀
e.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
f.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
③配制物质的量浓度的溶液,造成浓度偏高的操作是(填字母)。
a.溶解后的溶液未冷却至室温就转入容量瓶中
b.洗涤烧杯和玻棒的溶液未转入容量瓶中
c.定容时眼睛俯视刻度线
d.定容时眼睛仰视刻度线