 B . 磨豆
B . 磨豆 C . 沥浆
C . 沥浆 D . 煮浆
D . 煮浆
|
|
|
|
A.过滤 | B.分液 | C.蒸馏 | D.蒸发 |
①溶于水,得到无色透明溶液
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出.离心分离.
③取②的上层清液,向其中滴加溶液有沉淀生成.
该样品中确定存在的是( )
气体(杂质) | 通过除杂试剂 | |
A | C2H4(SO2) | 酸性高锰酸钾溶液 |
B | NH3(H2O) | 无水氯化钙 |
C | Cl2(HCl) | 饱和食盐水 |
D | NO(HCl) | 饱和NaHCO3溶液 |
选项 | 气体(杂质) | 方法 |
A | Cl2(HCl) | 通过饱和的食盐水 |
B | N2(O2) | 通过足量灼热的铜丝网 |
C | SO2(CO2) | 通过饱和的碳酸氢钠溶液 |
D | NH3(H2O) | 通过盛有碱石灰的干燥管 |
实验目的 | 实验操作 | |
A | 除去乙烷中的乙烯 | 将混合气体通入酸性高锰酸钾溶液 |
B | 除去乙醇中的水 | 加入生石灰,蒸馏 |
C | 鉴别苯和环己烷 | 加入溴水振荡,静置后观察分层及颜色差异 |
D | 分离苯和溴苯 | 加水后分液 |
选项 | 混合物 | 除杂试剂 | 分离方法 |
A | 苯(苯酚) | 浓溴水 | 过滤 |
B | 溴苯(溴) | NaOH溶液 | 分液 |
C | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
D | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| 选项 | 检验括号中的物质 | 检验试剂 |
| A | CO2气体(H2S) | CuSO4溶液 |
| B | Na2SO3溶液(Na2SO4) | BaCl2溶液 |
| C | 海水(KI) | 淀粉溶液 |
| D | 乙醇(水) | 金属钠 |
| 原物(杂质) | 除杂试剂 | 除杂方法 | |
| A | CO2(H2S) | CuSO4溶液 | 洗气 |
| B | 碳粉(MnO2) | 浓盐酸 | 加热后过滤 |
| C | 乙酸(乙醇) | 饱和Na2CO3溶液 | 蒸馏 |
| D | 硝基苯(NO2) | NaOH溶液 | 分液 |
| 选项 | 含杂质物质 | 除杂试剂 | 方法 |
| A | 乙烷(乙烯) | 溴水;浓硫酸 | 洗气 |
| B | | 品红溶液;NaOH溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 乙醇;浓硫酸 | 加热、分液 |
| D | Fe(Cu) | 稀硫酸 | 过滤、洗涤、干燥 |
选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
A | 己烷(己烯) | 溴水 | 分液 |
B | 苯甲酸(NaCl) | 水 | 重结晶 |
C | 溴苯(溴) | NaOH溶液 | 分液 |
D | 乙炔(H2S) | CuSO4溶液 | 洗气 |
选项 | 实验目的 | 方法 |
A | 分离固体碘和固体氯化铵 | 加热 |
B | 从自来水中获得蒸馏水 | 蒸馏 |
C | 除去粗盐中的泥沙 | 过滤 |
D | 从溴水中提取溴 | 萃取 |


已知:25℃时,Ksp[Co(OH)2]=2.0×10-15.下列说法正确的是( )


①相对于Cu2+ , 粗液中浓度过小,原因是(用离子方程式表示),不能得到硝酸铜晶体。
②粗液中浓度较大,但由于,不能得到硝酸铜晶体。
Ⅰ.用水溶解一定质量粗品,加入稀和
溶液,加热。
Ⅱ.待溶液冷却后,加入试剂X至溶液。过滤、洗涤,得到红褐色沉淀。
Ⅲ.用稀溶解红褐色沉淀,滴入
溶液,稀释至一定体积。将溶液红色的深浅与标准色阶对照,确定含量。
已知:完全沉淀的pH为6.7,
完全沉淀的pH为2.8
①Ⅰ中将氧化为
的离子方程式是。
②试剂X是。
序号 | 电压 | 阴极现象 | 阳极产物 | |
i | a | 无气泡,少量金属析出 | 无 | |
ii | b | 较多气泡,极少量金属析出 | 无 | |
iii | a | 少量气泡,少量金属析出, | 有 |
( ,
)
①iii中产生的原因有
、。
②溶液再生的合适条件是(填实验序号)。

回答下列问题:

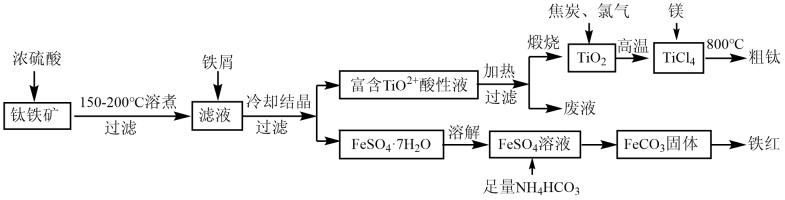
已知:①TiO2+易水解为TiO2·nH2O;高温下钛易与N2、H2等反应。
②常温下,Ksp [Fe(OH)2]=8.0×10-16 , Ksp[FeCO3]=3.2×10-11。
回答下列问题:

该小组同学查阅资料知:
①镍的化学性质与铁相似,能与酸缓慢反应。
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | ||||
开始沉淀时 | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时 | 8.7 | 4.7 | 3.2 | 9.0 |
a.氨水 b.稀 c.
d.
若调pH前 ,
和
浓度均为
, 则“调pH”需控制溶液pH的范围为。
