反应Ⅰ:
反应Ⅱ:
下列制取少量的实验原理和装置能达到实验目的的是( )






实验步骤:
①检查装置的气密性,称取样品(仅由纯碱与小苏打组成)10g,加到装置B中;
②连接装置,打开弹簧夹,先通一段时间空气后,关闭弹簧夹,打开分液漏斗活塞滴入稀硫酸至不再有气体生成;
③关闭分液漏斗的活塞,打开弹簧夹,继续通入一段时间空气。实验中记录的数据如表所示:
装置B | 装置C | 干燥管I | |
滴入硫酸前称得的质量/g | 180.0 | 30.0 | 120.4 |
滴入硫酸后称得的质量/g | 174.2 | 31.5 | 124.8 |
请回答下列问题:
①试剂X为。
②实验开始前,先打开弹簧夹,通入一段时间空气,其目的为,实验结束后,需要继续通入一段时间的空气,其目的是将装置内的赶到干燥管中被吸收。
③干燥管Ⅱ的作用是。
④有同学认为,表格中三组数据都可以计算该样品中的质量分数,但也有同学认为不能用装置C前后的质量差来计算,其理由是吸收的水蒸气并不全部来自反应生成;通过实验数据计算,食用碱中
的质量分数为(保留三位有效数字)。
 已知:25℃时,
已知:25℃时, 的
,
;
;
;该工艺中,
时,溶液中
元素以
的形态存在。
①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免
中混入
沉淀,溶液中
(列出算式)时,应停止加入
溶液。
②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量
,可析出
。

①该氧化物为。
②已知: 和
同族,
和
同族。在
与上层
的反应中,
元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。

已知:NaCl、NH4HCO3、NaHCO3、NH4Cl四种盐在不同温度下的溶解度如下表所示:
温度溶解度(g) 物质 | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 70℃ |
NaCl | 35.8 | 36.0 | 36.3. | 36.6 | 37.0 | 37.3 | 37.8 |
NH4HCO3 | 15.8. | 21.0 | 27.0 | 一 | 一 | — | — |
NaHCO3 | 8.15 | 9.6 | 11.1 | 12.7 | 14.45 | 。16.4 | 一 |
NH4Cl | 33.3 | 37.2 | 41.1 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:

完成下列填空:
画出乙中实验装置图,并标出相应试剂。
写出侯氏制碱法中生成NaHCO3的离子方程式。操作时,往饱和食盐水中先通入气体,原因是。
实验流程及实验装置图如下:

回答下列问题:
a导管末端多孔球泡的作用。
i.称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中:
ii.移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用0.1000mol·L-1盐酸标准溶液滴定至溶液由浅红色变无色(第一滴定终点), 消耗盐酸V1mL;
iii.在上述锥形瓶中再加入2滴指示剂N,继续用0.1000mol·L-1盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2mL;
iv.平行测定三次,V1 平均值为22.25,V2平均值为23.51。
回答下列问题:
指示剂N为, 第二滴定终点的现象是。
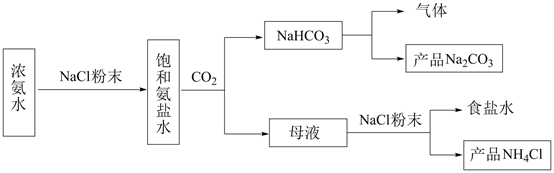
回答下列问题:
A. 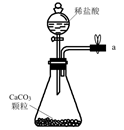 B.
B. 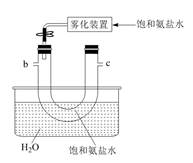 C.
C.  D.
D. 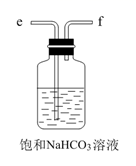 E.
E. 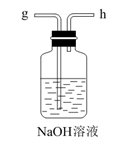
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2 , Na2O2增重0.14g,则固体NaHCO3的质量为g。
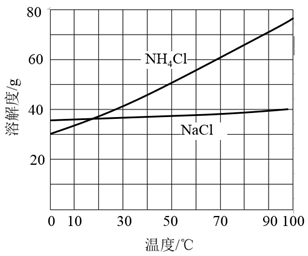
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为、、洗涤、干燥。