等产物在化工生产中都有广泛用途。下列有关
的说法正确的是( )

 C . 用电子式表示
C . 用电子式表示 D .
D . 
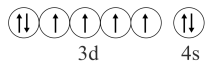
①基态Cu原子的M层电子排布式为。
②CO和N2互为等电子体。标准状况下V L CO分子中π键数目为。


 B .
B .  D .
D . ①H2O分子的键角小于H3O+离子的键角,原因是。
②画出可能的一种结构式。

①立方晶系TiO2晶胞参数如图甲所示,若用NA表示阿伏加德罗常数,其晶体的密度为g/cm3。
②图乙的结构可用化学式TiO2-xNy表示,其中x=。
②南开大学某课题组成功合成了无机二茂铁类似物[Fe(η4- P4)2]2-。环状是芳香性π配体,P的杂化方式是 ,
中的大π键应表示为(分子中的大π键可用符号
表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数)


②铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为a pm,阿伏加德罗常数为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。



①基态 Ni原子的价电子排布式为,该元素在元素周期表中的位置是。
②C、N、O的电负性的由大到小的顺序是。
③为寻找更多的金属催化剂,科学家从众多金属元素中选取Co、Fe、Cu进行了相关研究,并取得了成功。选取这三种金属进行相关研究的原因可能是。
①请解释CH4、H2O、CO2的键角大小顺序。
②(HB=NH)3中B、N原子的杂化轨道类型分别为。
③氨硼烷(NH3BH3)中N、B都达到稳定结构,用化学键表示出(NH3BH3)分子的结构式。
①该晶体储氢后的化学式为。
②储氢材料的储氢能力= , 若晶胞参数为apm,忽略吸氢前后晶胞的体积变化,标准状况下氢气的密度为bg·cm-3 , 则该储氢材料的储氢能力为。(NA表示阿伏加德罗常数,写出表达式即可)

①比较硫化氢与氨气键角的大小:H2SNH3(填“>”或“<”) 。
②第二周期元素中,第一电离能大于N的元素有(用元素符号表示)。
③请解释该化合物易溶于水的主要原因:。
④该环状络合物中,VSEPR模型为四面体或正四面体的非金属原子共有个。


①In的配位数为;晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为。
②若晶胞底边正方形的边长均为anm,高为cnm,阿伏加德罗常数的值为NA设晶体的最简式的式量为Mr,则该晶体的密度为g·cm-3(列出计算式)。

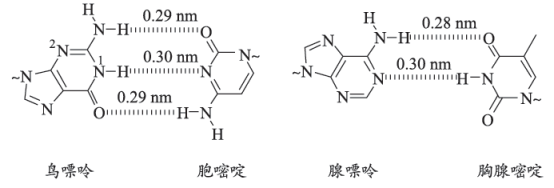
①鸟嘌呤中2号N的杂化类型为。
②鸟嘌呤中N—H键的平均键长。(填“大于”“小于”或“等于”)0.29nm。
①碱基中,O、N能与H形成氢键而C不能,原因是。
②下列说法正确的是(填序号)。
a.氢键的强度较小,在DNA解旋和复制时容易断裂和形成
b.鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强
c.碱基配对时,一个H可以同时与多个原子形成氢键
①鸟嘌呤异构化后的结构简式为。
②鸟嘌呤异构化后最有可能配对的嘧啶碱基是。。
②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。SeO的空间构型为,TeO
中碲原子的杂化类型是。
③H2O、H2S、H2Se、H2Te的键角依次(填“变大”、“变小”或“不变”)。

Cu+填充了晶胞中四面体空隙的百分率是,S2-配位数为。已知图1中A原子的原子分数坐标为(0,0,0),则与A原子距离最近的Cu+的原子分数坐标为。若晶胞参数a nm,晶体的密度为d g·cm-3 , 则阿伏加德罗常数的值为(用含a和d的式子表示)。

①组成该化合物的非金属元素的电负性由大到小的顺序为(用元素符号表示)。
②该分子中采用sp2杂化的非金属元素的原子个数为。

①P原子的配位数为。以A为原点建立三维坐标系,请在图3中画出晶胞中各原子沿z轴的透视图(用“![]() ”代表Mo原子,用“
”代表Mo原子,用“![]() ”代表P原子,用“
”代表P原子,用“”代表Mo原子和P原子的重合)。
②若晶胞中距离最近的Mo原子之间的距离为anm,阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3。(列出计算式即可)

Cu+填充了晶胞中四面体空隙的百分率是,S2-配位数为。若晶胞参数a nm,晶体的密度为dg·cm-3 , 则阿伏加德罗常数的值为(用含a和d的式子表示)。

①[Cu(H2O)4]2+呈蓝色,但溶液Ⅰ却呈黄绿色,其原因是,为了能观察到溶液Ⅰ中[Cu(H2O)4]2+呈蓝色,可采取的方法是。
②CuCl2溶液中的铜主要以[Cu(H2O)4]2+、[CuCl4]2-形式存在。常温下,将CuCl2溶于浓盐酸中,测定平衡体系中:[Cu(H2O)4]2+浓度为a mol•L-1、Cl-浓度为b mol•L-1、[CuCl4]2-浓度为c mol•L-1 , Cl-的转化率为(用a、b、c中的字母表示)。
③常温下,用惰性电极电解浓度较大的CuCl2溶液,当电解到阴极附近出现蓝色Cu(OH)2絮状物,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=mol•L-1 (已知:Cu(OH)2的Ksp=2.2×10-20)
④向溶液Ⅱ中通入NH3至过量观察到的现象是。