选项 | 实验目的 | 实验设计 |
A | 除去乙酸乙酯中的乙酸 | 加入NaOH溶液,振荡后分液 |
B | 验证非金属性:O>S | 向 |
C | 由 | 将 |
D | 配制100mL一定物质的量浓度的NaOH溶液 | 准确称取NaOH固体,放入100mL的容量瓶中,加水溶解,振荡摇匀,定容 |
选项 | 主要物质(杂质) | 除杂试剂 |
A | FeCl2溶液(FeCl3) | H2O2 |
B | CO2(CO) | 饱和NaHCO3溶液 |
C | Fe2O3(Al2O3) | NaOH溶液 |
D | Na2CO3固体(NaHCO3) | HCl溶液 |
A | B | C | D | |
物质(杂质) |
| 碳粉( | 乙酸(乙醇) | 硝基苯( |
除杂试剂 |
| 浓盐酸 | 新制CaO | NaOH溶液 |
除杂方法 | 洗气 | 加热后过滤 | 蒸馏 | 分液 |
选项 | 被提纯物质 | 除杂试剂 | 操作 |
A | 乙烯(甲烷) | 溴水 | 洗气 |
B | 溴苯(溴) | CCl4 | 萃取 |
C | 乙醇(乙酸) | 金属钠 | 蒸馏 |
D | 淀粉溶液(葡萄糖) | —— | 渗析 |
物质(杂质) | 除杂试剂 | |
A | FeCl2溶液(FeCl3) | Fe粉 |
B | Cl2(HCl) | 饱和的食盐水 |
C | NaCl溶液(CaCl2) | Na2CO3溶液、HCl溶液 |
D | CH2=CH2 (SO2) | 酸性高锰酸钾溶液 |

回答下列问题:

若“沉铈”中,Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5mol·L-1 , 此时溶液的pH为5,则溶液中c()= mol·L-1 (保留2位有效数字)。
已知常温下:
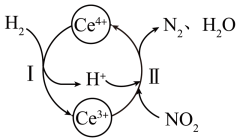
①该反应中的催化剂为(写离子符号);
②该转化过程中还原剂与氧化剂物质的量之比为。

已知:I.放电时负极的电极反应式为;
II.常温下, , 当溶液中某离子浓度低于
时,认为该离子已沉淀完全。
回答下列问题:


请回答下列问题:
②滤渣成分的化学式是

①该装置中铜电极应连接直流电源的极。
②石墨电极的电极反应式为。
③当有0.1molCu2O生成时电路中转移mol电子。

查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42- , 自身被还原为Bi(OH)3固体。
ii.
物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Bi(OH)3 |
开始沉淀的pH | 2.7 | 3.4 | 4.6 | 7.5 | 0.7 |
完全沉淀的pH | 3.7 | 4.4 | 5.9 | 9.7 | 4.5 |
回答下列问题:


已知:I.不同浸出剂“酸溶”结果
浸出剂 | 浸出液化学成分/(g·L-1) | 钴浸出率/% | |
Co | Al | ||
HCl | 80.84 | 5.68 | 98.4 |
H2SO4+Na2S2O3 | 84.91 | 5.96 | 98.0 |
II.Al3+在pH为5.2时沉淀完全。
III.LiF的Ksp为1.8×10-3。
回答下列问题:

已知:Ⅰ.透明氧化铁又称纳米氧化铁,粒子直径很微小(10 ~ 90 nm) ,包括氧化铁黄( FeOOH)和氧化铁红( Fe2O3) ,难溶于水,在碱性条件下非常稳定;
Ⅱ.Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
 ” 环节的目的是。
” 环节的目的是。

称取3.47 g透明氧化铁,用稀硫酸溶解并定容至1 L, 准确移取该溶液10.00 mL,加入足量KSCN溶液,再用蒸馏水定容至100 mL。测得溶液吸光度A =0. 8,则透明氧化铁中氧化铁黄的质量分数为 ;若吸光度 A减小,则氧化铁黄的含量将(填“增大”或“减小”)。
①甲同学过滤时的下列操作规范的是(填编号)。
a.用玻璃棒引流
b.漏斗口未紧靠烧杯内壁
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高于漏斗边缘
e.用玻璃棒在漏斗中搅动以加快过滤速度
②滤液加入K3[Fe(CN)6]溶液或KSCN溶液均未出现明显现象,其主要原因为 。
步骤一:取本品10片,碾碎后加入一定浓度试剂a,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量H2O2溶液,后加入过量NaOH溶液生成沉淀,将沉淀过滤、洗涤、干燥后灼烧至固体质量恒定,得0. 64g固体。
①步骤一中加入的试剂a为 。
②步骤三中,加入H2O2溶液发生反应的离子方程式为 ,灼烧后 所得固体的颜色为 ,灼烧时需要使用下列仪器中的 (填编号)。
a.酒精灯 b.坩埚 c.蒸发皿 d.铁架台(带铁圈) e.三脚架
③若将步骤三中的H2O2 溶液换为Cl2也能达到目的,但使用H2O2溶液的好处是。
④由实验数据计算,每片药片中约含Fe2+ mg。
第I步:称取20.0g粗盐(含MgCl2、CaCl2、Na2SO4杂质),用80mL水溶解,加入1.0mol/L BaCl2至观察不到明显沉淀为止,用倾析法分离,保留滤液。
第II步:向滤液中先后加入过量2.0mol/L NaOH、1.0mol/L Na2CO3 , 过滤,再用3.0mol/L HCl调节pH至1~2。
第III步,加热浓缩至溶液刚刚出现微晶膜。
第I步加入BaCl2时,证明SO已经除净的实验方法是。
第IV步,将第III步浓缩溶液转移至下图装置C中继续实验。

装置A中发生的化学反应方程式为,控制该反应速率可采取的措施(任答一点即可)。