

实验室提供3W、5W、9W、12W、21W五种LED灯带,质量分数为5%的碳酸氢钠溶液、蒸馏水、计时器及其它实验所需的仪器。
建议:①实验可设计4~5组;②碳酸氢钠溶液取50毫升;③每次实验时间30分钟。
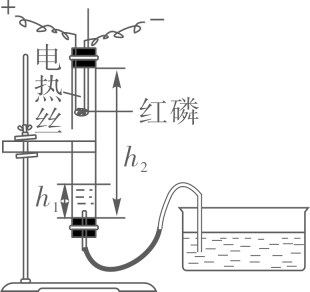
①连接装置并检查装置气密性;
②向玻璃管和水槽内加适量的水,测量玻璃管内液面到橡胶塞的距离为h1;
③在燃烧匙里放足量红磷,塞紧塞子,测量两个橡胶塞间的距离为h3 , 调节水槽内水面高度与玻璃管内的水面相平;
④接通电源,待红磷燃烧,断开电源;
⑤反应结束后,当温度恢复至室温,水不再进入玻璃管时,再次调节水槽内水面高度与玻璃管内的水面再次相平,测量此时玻璃管内液面到橡胶塞的距离为h2;
⑥重复实验,得出结论。
[查阅资料]
①氨气极易溶于水,溶液显碱性;氨气能被浓硫酸吸收。
②碱石灰是氢氧化钠和生石灰两种固体的混合物。
③碳酸氢钠分解的化学方程式为:2NaHCO3 Na2CO3 +H2O+CO2↑。
④碳酸氢铵分解的化学方程式为: NH4HCO3 H2O+CO2↑+NH3↑。
[设计实验]
小组同学设计了实验方案,如图所示(装置气密性良好,部分夹持仪器已略去)

[实验步骤与现象]
①打开止水夹1,关闭止水夹2,点燃酒精灯,观察到澄清石灰水变浑浊。
②打开止水夹2,关闭止水夹1,观察到无色酚酞试液变为红色,熄灭酒精灯。
[实验分析]
[实验反思]乙同学提出:通过以上现象不能确定该膨松剂中只含有碳酸氢铵。经过小组讨论,他们继续进行探究:关闭止水夹2,打开止水夹1,继续加热,当观察到B中导管口不再产生气泡,并观察到现象,可得出结论:该膨松剂是碳酸氢铵和碳酸氢钠的混合物。



【提出假设】植物根系等比例吸收矿质元素和水分。
【实验设计】根据上述研究目的,设计相应的实验方案及记录表如下:
|
实验条件 |
检测项目(相同时间内) |
||
|
水分蒸腾量 |
矿质元素含量变化 |
||
|
氮元素、磷元素 …… |
|||
|
甲 |
较强的光照 |
m1 |
n1 |
|
乙 |
较弱的光照 |
m2 |
n2 |
【数据处理】实验后对表中的数据进行处理,初步证实假设成立与否。
【实验结论】植物根系不是以等比例的方式吸收矿质元素和水分。
①取一只洁净的坩埚,称其质量为a g;再向其中加入样品.称得总质量为m1 g;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④ ? , 称得坩埚和剩余固体的总质量为m2 g.


已知:①在 68℃时,Cu(OH)2 会分解;在 500℃时,Fe(OH)3会分解.二种物质的分解产物均为氧化物且化合价不变.
②装置气密性良好,试剂均足量,反应均完全,杂质不参与反应也不分解.
Ⅰ.将质量为m的样品放入硬质玻璃管中,称量装置B的质量m1.
Ⅱ.连接好装置。缓缓通入N2一会儿,再开始加热并控制温度在100℃左右.反应结束后称量装置B的质量m2.
Ⅲ.重复步骤Ⅱ,控制温度在550℃左右.反应结束后再次称量装置B的质量m3.
实验数据记录如下表:
| 温度/℃ | 室温 | 100 | 550 |
| B装置/g | m1 | M2 | M3 |
请回答下列问题:

【査阅资料】蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH:蚁酸在一定条件下会分解生成两种氧化物。
【提出问题】蚁酸分解生成的两种氧化物是什么?
【建立猜想】
①蚁酸分解的产物中一定含有水;
②蚁酸分解的产物中可能含有二氧化碳;
③蚁酸分解的产物中可能含有一氧化碳。
【实验探究】
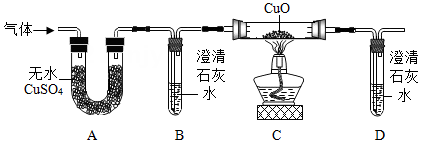


PAM测量仪,玻璃水槽,量筒,可调温度的恒温箱,含PAM浓度为0.5克/分米3土壤
浸出液,浓度相同的降解菌A和B培养液。实验时,每组取土壤浸出液50毫升,降解菌培养液2毫升,每组实验时间约10天。
小明查阅资料发现:
①氢氧化钠溶液的浓度越大,粘性越强,液体不易流动;
②氢氧化钠溶液吸收二氧化碳时会放热。
小明想探究是否高浓度的氢氧化钠溶液,粘性增强,影响了反应的进行。实验使用如图的装置以及大烧杯、秒表、碎冰、蒸馏水、足量40%氢氧化钠溶液等实验器材和药品。

①检查装置的气密性;

已知:①NH4HCO3 NH3↑+CO2↑+H2O;
②NH3能被浓硫酸吸收,不能被氢氧化钠固体吸收。
|
装置 |
反应前质量/克 |
反应后质量/克 |
|
B |
186 |
198.4 |
|
C |
159 |
162.4 |
①准备如图乙的玻璃容器,顶部用密封盖密封,并检查该装置的气密性。
②将氧气传感器(能实时显示容器内氧气的体积分数)固定在容器内壁,并装入足量的红磷。
③用激光笔点燃红磷,红磷剧烈燃烧,观察并记录氧气传感器所显示的氧气体积分数的变化情况。
④分别用白磷、食品脱氧剂(可以直接与氧气反应)替换红磷重复上述步骤①~③。
⑤根据实验数据,分别绘制三种物质氧化时容器内氧气体积分数随时间的变化情况,如图丙所示。


回答下列问题:
①步骤V中所加试剂是
②写出由贝壳得到CaO的化学方程式
①选取n张对称性良好的樟树叶片,将每张叶片标记为如图的A、B两部分;
②将叶片的A部分作遮光处理,B部分不作处理;
③光照t小时后,在所选的每张叶片A、B的对应部位各截取面积为S的小方片,分别烘干,称得A部分小方片总质量为mA , B部分小方片总质量mB;
④计算出樟树叶光合作用速率;


【建立猜想】
猜想一:Ca(OH)2溶液与CO2不反应,是CO2溶于水导致瓶内气压变小而变瘪。
猜想二:Ca(OH)2溶液与CO2反应,生成了可溶性物质。
【设计实验】
| 实验 | 步骤与操作 | 实验现象与结果 | 结论 |
| 一 | 1.取2个相同的软塑料瓶,分别集满CO2气体,编号为A、B | 两瓶内气体无色透明,瓶子形状正常 | Ca(OH)2溶液与 CO2发 生了化 学反应 |
| 2.分别向A、B两瓶中加入等量的饱和Ca(OH)2溶液和水,立即拧紧瓶盖并振荡 | 两瓶内液体未出现浑浊;两瓶均变瘪,A瓶变瘪程度更大 | ||
| 二 | 1.测出反应前Ca(OH)2溶液的pH | 大于7 | |
| 2.测出反应后A瓶内液体的pH | 小于7 |

【模型应用】同学们为探究草酸(H2C2O4)受热分解的气体成分,将草酸(H2C2O4)受热分解后得到的混合气体通过该思维模型进行实验。
【查阅资料】
草酸易溶于水,草酸受热分解时有少量升华,草酸蒸气与石灰水会反应生成草酸钙或草酸氢钙,这两种生成物都为白色不溶物。
【建立猜想】猜想1:草酸分解生成CO2和H2;
猜想2:草酸分解生成CO2、CO和H2O;
猜想3:草酸分解生成CO2和H2O;

【收集证据】该小组同学根据B中的澄清石灰水变浑浊的现象认为气体中有CO2存在。则你认为根据图甲实验方案证明气体中一定有CO存在的证据是。
【继续探究】
小金同学为测定草酸晶体样品中草酸的质量分数,设计了如下图方案:称取一定量草酸晶体样品进行充分加热,完全分解后得到的混合气体,用下图装置按正确的操作流程进行实验(杂质不参与反应,所用试剂均足量),通过称量装置C中氧化铜粉末反应前后的质量差,由此来计算出样品中草酸的质量分数,而得到的实验结果却比实际值偏低很多,排除仪器和操作因素且装置气密性良好,你认为其可能原因是: 。(写出一条即可)

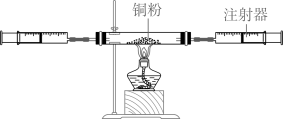
⑴实验中,要让氧气和铜粉充分反应,同学们的操作方法是。
⑵实验结束后,立即测得装置内气体总体积为450毫升。
⑶分析数据得出结论:人体呼出气体中O2的体积分数为。
⑷实验反思:查阅教材得知,人体呼出的气体中氧气的体积分数为16%,实验中测得的氧气体积分数与教材中的数据差异较大,其原因是。
|
分组 |
实验处理 |
气孔开放程度 |
||
|
完全开放(%) |
半开放(%) |
关闭(%) |
||
|
A |
pH为7的KCl溶液+太阳光照 |
40.0 |
42.0 |
18.0 |
|
B |
pH为7的KCl溶液+黑暗处理 |
1.0 |
11.0 |
88.0 |
|
C |
pH为4.5的KCl溶液+太阳光照 |
21.0 |
42.0 |
37.0 |
|
D |
pH为7的NaCl溶液+太阳光照 |
15.0 |
25.0 |
60.0 |
备注:上述溶液体积及离子浓度均相同。



法国科学家拉瓦锡最旱通过实验测定出空气中氧气的体积分数,其过程如下:
①在曲颈甄中放入少量水银,右侧的水槽中装入水银并罩上钟罩,将曲颈甄的瓶口伸入钟罩内水银的上方(如图);
②将曲颈甄放在炉上持续加热12天;
③观察钟罩内液面上升的体积;
④计算出空气中氧气的体积分数约为空气的1/5。

根据拉瓦锡研究氧气体积分数的过程,阿青总结并构建了以下解决“测量混合气体中某种气体成分体积分数”类问题的思维模型:

拉瓦锡之后,英国化学家卡文迪许也对空气成分作过一些探究:在一个密闭的容器中,①用电火花使氮气跟氧气化合,并继续加入氧气使氮气全部转化为氮的氧化物:②用碱液全部吸收氮氧化物,剩余的氧气用红热的铜除去:③打开止水夹,让水进入装置:④得出结论……请你利用阿青的思维模型进行分析,并回答下列问题:
①一次性液体打火机充装燃料为丙烷(C3H8),常温常压下为无色气体,不易溶于水,密度比空气大;
②工业上从石油中分离出丙烷。实验室可用干燥的丁酸钠、氢氧化钠固体、氧化钙固体混合加热来制取丙烷,方程式为:CH3CH2CH2COONa+NaOHC3H8+Na2CO3
③丙烷完全燃烧产生水和二氧化碳:若氧气不充足时,有一氧化碳生成。一氧化碳有剧毒性。于是,小盛制取丙烷并对其燃烧产物进行了探究,所用部分装置如下图所示:
