
【提出问题】废液中含有什么溶质?
【猜想与假设】猜想1:废液中含有CaCl2、NaCl两种溶质。
猜想2:废液中含有CaCl2、NaCl、Ca(OH)2三种溶质。
猜想3:废液中含有 (写化学式)三种溶质。
【实验探究】甲同学取少量废液于试管中,向其中滴加紫色石蕊试液,溶液呈红色。
①根据实验现象可以确定猜想 成立。
②乙同学取少量废液于试管中,加入氧化铜粉末并加热,可观察到溶液变蓝色,得
出与甲同学相同的结论。
【结论与反思】甲同学认为往废液中滴加硝酸银溶液,观察到白色沉淀,也可获得上述结论,你认为是否合理并说明理由 。
(查阅资料)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4•3H2OCO2↑+CO↑+4H2O
碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。为了测定铁红中铁的质量
分数,小组同学进行如下实验。(装置气密性良好,尾气处理装置未画出。)

a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
探究一:氢氧化钠固体是否变质:兴趣小组同学取少量氢氧化钠固体样品于试管中,加适量水溶解,滴加稀盐酸,产生大量气泡。回同答下列问题:
【查阅资料】:
①碱石灰是NaOH和CaO的固体混合物,能吸收水和二氧化碳
②标准状况下,二氧化碳的密度ρ=1.977g/L
③碳酸钠溶液与氯化钙溶液能发生反应:Na2CO3+CaCl2=CaCO3+2NaCl
【设计实验】:甲、乙两兴趣小组同学分别称取2g氢氧化钠样品与足量稀盐酸反应,通过测定产生二氧化碳的量进行计算。甲小组同学设计了如图所示的方案一测定二氧化碳的质量。(注:不考虑稀盐酸中HCl气体的挥发)

【交流讨论】
乙小组同学认为方案一的C装置气管水面上应覆盖一层植物油,防止二氧化碳溶于水,由此提出了方案二,但甲小组同学认为方案二的装置也存在缺陷,会对实验结果产生影响。请你指出产生影响的原因:(写一点)。

“操作I”的名称是;



[提出问题]碳燃烧时可能生成CO2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
[作出猜想]猜想①:CO;猜想②:CO2;猜想③:CO和CO2。
[设计方案]实验装置如图乙。打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。
方案一:从定性观察角度判断猜想①成立的实验现象是
方案二: 从定量计算角度判断。
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
|
反应前的质量 |
反应后的质量 |
|
|
A(玻璃管+固体) |
m1 |
m2 |
|
B+C(广口瓶+混合液) |
m3 |
m4 |


一般情况来看, 金属的冶炼与金属的性质有关, 如图是铁、 铜、 铝三种金属冶炼的先后顺序, 则这三种金属的活泼由强到弱是:。

|
温度(℃) |
10 |
20 |
30 |
40 |
60 |
80 |
100 |
|
|
溶解度 |
硝酸钾 |
20.9 |
31.6 |
45.8 |
64 |
110 |
169 |
248 |
|
氯化钠 |
35.8 |
36 |
36.3 |
35.4 |
37 |
38.4 |
39.8 |
|
|
实验操作 |
实验现象 |
实验结论 |
|
步骤1:取少量滤液于试管中,向其中滴加足量硝酸钡溶液 |
有白色沉淀生成 |
滤液中的溶质是
|
|
步骤2:静置,向上层清液中滴加无色酚酞溶液 |
溶液变红 |


①假设在现有“强热”条件下,生成的HCl以气体形式全部逸出,则在反应物稀释液中滴加石蕊试液,试液(填现象)。
②为了证明反应剩余物中是否含有Cl- , 现取少量反应物稀释液于试管,滴加溶液,再取上层清液滴加硝酸银和稀硝酸,若有白色沉淀生成,则含有Cl-。

【提出问题】烧杯D中上层清液含有哪些溶质(除指示剂外)?
【分析讨论】小组讨论后认为,确定反应后物质成分的思维路径:①考虑反应物用量的不同;②抓住化学反应的本质,即微粒的重组。某小组同学分析过程笔记如下:

小组按如下方案进行实验探究
|
实验 |
实验内容 |
实验现象 |
实验结论 |
|
Ⅰ |
取少量上层清液于试管中,加入过量碳酸钠溶液,静置。 |
无沉淀,溶液呈红色 |
肯定没有Ca2+ |
|
Ⅱ |
取少量上层清液于试管中,加入过量“?”溶液,静置。 |
有白色沉淀,溶液呈红色 |
肯定有OH-、CO32- |
根据实验Ⅰ可以初步推断:上层清液中溶质(除指示剂外)所有可能的组成(用化学式表示);
【实验结论】烧杯D中上层清液的溶质有指示剂、氯化钠、氢氧化钠、碳酸钠。
资料:①Fe,FexCy 在加热时与O2 反应能生成相应氧化物。
②FexCy 不与酸反应。
实验1:取29.52g 样品,加入足量稀H2SO4 , 充分反应后生成1.00gH2。
实验2:另取29.52g 样品,按如图进行实验。

表:装置A 和B 的质量变化
| 装置 | A | B |
| 反应前 | 300.00 | 400.00 |
| 反应后 | m | 400.44 |
实验后A 中固体全部变为红棕色,装置A、B 的质量变化如上表。

【资料】①已知白色固体为碱式碳酸镁,化学式为Mgx(OH)2(CO3)4 , 高温完全分解生成MgO、H2O、CO2。
②浓H2SO4吸收水蒸气,碱石灰能吸收水蒸气和CO2气体。
【实验】称取一定质量固体按下图进行实验。持续加热至完全分解,最终得到MgO 20.0g,B、C装置最终分别增重1.8g、17.6g。

①实验前需进行的操作:连接装置,。
②加热前、后均需通入氮气,停止加热后通氮气的作用是。(选填字母)
A.防止倒吸 B.使生成的H2O和CO2气体分别被后续B、C装置完全吸收
③根据实验数据,确定白色固体的化学式为。

【查阅资料】①Cl2是黄绿色、有刺激性气味的气体。②CuCl2在水中解离出 Cu2+、Cl﹣。
【实验二】为了进一步探究CuCl2溶液中哪种离子起催化作用,乙同学做了如图所示的对比实验。那么图中X、Y两个位置填写的数据应该为 、。若要证明CuCl2溶液中的Cu2+对H2O2分解起催化作用,除观察到试管c中无明显现象外,还需观察到的现象为 。
【实验三】丙同学补充如下实验来进一步探究。(提示:CuCl2+2NaOH=2NaCl+Cu(OH)2↓)
|
实验操作 |
实验现象 |
数据处理 |
结论 |
|
向a试管反应后的溶液中加入过量的氢氧化钠溶液 |
有蓝色絮状沉淀产生 |
将沉淀过滤,洗涤,晾干、称量得m2g。则m1、m2的关系为m1=(用m2表示) |
氯化铜反应前后质量未变 |
进行研究.
【收集资料】
通过阅读标签及查阅资料,她获得如下信息:
⑴该固体酒精中含有酒精、氯化钙、氢氧化钠三种物质;
⑵酒精的化学式为 C2H5OH; (3)氯化钙、氯化钡的水溶液均呈中性.
【提出问题】
⑶酒精的化学式与 NaOH 相比,都有“OH”,那么酒精的水溶液是不是显碱性?
⑷固体酒精中的氢氧化钠是否变质及变质的程度如何?
实验一:她取少量酒精溶液于试管中,滴加硫酸铜溶液,未观察到蓝色沉淀,说明酒精溶液(填“显”或“不显”)碱性.
除去部分变质的氢氧化钠溶液中的杂质,方法是(用化学方程式表示).
[查阅资料]
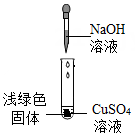
①NaOH与CuSO4反应会生成Cu(OH)2 , 也会生成Cu4(OH)6SO4(碱式硫酸铜)。
②Cu(OH)2在80℃会分解生成CuO。
③ Cu4(OH)6SO4不溶于水,能与酸反应,分解温度需300℃。
[猜想与假设]
猜想一:浅绿色固体为Cu(OH)2和Cu4(OH)6SO4
猜想二:浅绿色固体为Cu(OH)2 猜想三:浅绿色固体为
[获取事实与证据]
|
步骤 |
实验操作 |
实验现象 |
|
1 |
取少取浅绿色固体放入试管中,加热至100℃ |
产生黑色固体物质 |
|
2 |
另取少量浅绿色固体放入试管中,加入足量稀硫酸,再滴加 Ba(NO3)2 溶液 |
浅绿色固体消失,产生白色沉淀 |
⑴根据步骤1的现象,说明浅绿色固体中存在 。
⑵小明根据上面的实验操作,认为猜想一是正确的。请对他的观点作出评价。 。
实验过程:
①取少量废水加入过量的盐酸,有白色沉淀生成,过滤,得沉淀物和滤液。向沉淀中加入稀硝酸白色沉淀不溶解。
②将所得滤液分成两份,一份滤液中加入适量的稀硫酸产生白色沉淀,过滤,向沉淀物中加入稀硝酸沉淀不溶解。
③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀。
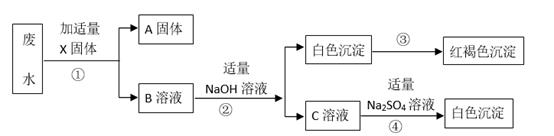
X固体为

A.b点→a点 B.c点→a点 C.c点→b点 D.c点→d点


碱式碳酸铜和碱式氯化铜分别属于无害锈和有害锈,解释原因: 。

①装置丙的作用是 。
②实验前、后均需对装置甲、乙、丙进行称重;当装置甲中固体质量不再减少,对装置甲、乙、丙进行再次称重前,需打开活塞再次通入足量的N2 , 其目的是 。
③若碱式碳酸铜的化学式为Cu2(OH)2CO3 , 则装置乙将增重 克。