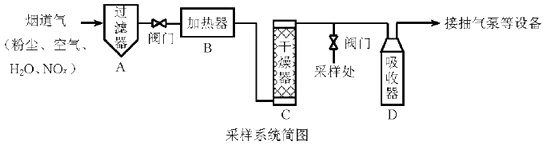
a.碱石灰
b.无水CuSO4
c.P2O5

将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3− , 加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+ , 终点时消耗v2 mL。
NO被H2O2氧化为NO3−的离子方程式是。
3Fe2++NO3−+4H+=NO↑+3Fe3++2H2O
Cr2O72−+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为mg·m−3。
若缺少采样步骤③,会使测试结果。
若FeSO4标准溶液部分变质,会使测定结果。
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
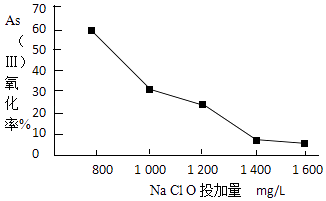
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是.
已知:一定条件下,As(Ⅴ)的存在形式如表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO3﹣ | HAsO42﹣ | HAsO42﹣、AsO43﹣ |
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是.
图1  图2
图2 
①则其化学式为。
②该晶体中距离Sn原子最近的Cu原子有个。
③若晶体密度为8.82g·cm-3 , 最近的Cu原子核间距为pm(用含NA的代数式表示,设NA表示阿伏加德罗常数的值)。
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As

已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是.
已知:一定条件下,As(Ⅴ)的存在形式如表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO3﹣ | HAsO42﹣ | HAsO42﹣、AsO43﹣ |
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是.
NO NO2
N2
反应Ⅱ的离子方程式是;
①NH2OH的水溶液呈弱碱性的原理与NH3相似,NH2OH的水溶液中主要离子有
(填离子符号).
②某离子化合物的组成元素与NH2OH相同,其水溶液显酸性.该物质是
(填化学式),其溶液中离子浓度由大到小的顺序为.
①写出N2H62+在碱性溶液中反应的离子方程式.
②NH2﹣的电子式为,N采用杂化方式,粒子空间构型为.
①尿素中元素原子半径最大的原子结构示意图为;
②尿素在土壤中的脲酶作用下会水解生成碳酸铵或碳酸氢铵,若与碱性肥料混合施用,会造成氮元素损失,请用离子方程式解释其原因;
③已知:20℃时,H2CO3:Ka1=4.2×10ˉ7、Ka2=5.6×10ˉ11;NH3•H2O:Kb=1.7×10ˉ5 , 碳酸氢铵溶液中HCO3ˉ、NH4+、OHˉ、H+四种离子浓度由大到小的顺序为
羟胺(NH2OH)可看做是氨分子内的1个氢原子被羟基取代的物质,常用作还原剂.
①利用羟胺的还原性,可以除去含Fe2+中的Fe3+ , 氧化产物是一种性质稳定、无污染的气体,写出反应的离子方程式②制备NH2OH•HCl(盐酸羟胺)的一种工艺流程如图所示:

ⅰ步骤中,发生反应的化学方程式为;
ⅱ步骤中使用的NaNO2外观酷似食盐,误食会中毒.可用电解法将工业废水中少量的NO2ˉ转化为N2以降低其危害.写出NO2ˉ在酸性条件下转化为氮气的电极反应式为.
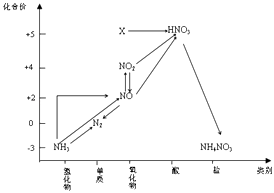
图1为氮及其化合物的类别与化合价对应的关系图.

①化学方程式是.
②用水吸收多余的氨气时,如将导管直接插入水中,会产生倒吸现象,产生该现象的原因是 .
a.汽车尾气中产生的NO:N2+O2 2NO.
b.氨的催化氧化:.
NO2易溶于水.标准状况下将体积为V mL的试管充满NO2后倒扣在水中,见图2.

①NO2溶于水的化学方程式是.
②使试管中NO2恰好完全被水吸收需要缓慢通入氧气,通入标准状况下氧气的体积为.最终试管中所的硝酸的物质的量浓度为.
③为了消除NO2的污染,可将它与氨气在催化剂作用下反应,生成水和一种无污染的物质,该物质是空气的主要成分之一,该反应的化学方程式是.

①写出阴极的电极反应式.
②分析产品室可得到H3PO2的原因.
③早期采用“三室电渗析法”制备H3PO2 , 将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是杂质.该杂质产生的原因是:.
a.NH3比PH3稳定性强
b.氮气与氢气能直接化合,磷与氢气很难直接化合
c.硝酸显强氧化性,磷酸不显强氧化性
d.氮气常温是气体,磷单质是固体