①称取 ,配成
溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入 溶液。
③持续磁力搅拌,将 溶液以
的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在 干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
可供选择的试剂: 、
、
、
、饱和
、饱和
可供选择的发生装置(净化装置略去):

相关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 分解温度/℃ |
Mg | 649 | 1090 | >300 | Mg3N2:>800 |
已知:Mg3N2溶于水发生反应Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
从结构上解释N2化学性质稳定的原因。上述固氮反应的化学方程式是。固氮的适宜温度范围是。(填编号)
a.500~600℃ b.700~800℃ c.900~1000℃
选用H2O进行转化,发现从体系中分离出NH3较困难,若选用HCl气体进行转化,发现能产生NH3 , 且产物MgCl2能直接循环利用,但NH3的收率较低,原因是。
活性炭还原NO2的原理为2NO2(g)+2C(s)N2(g)+2CO2(g)。一定温度下,在2L恒容密闭容器中充入1molNO2和足量C发生该反应(不考虑2NO2
N2O4)。实验测得NO2的转化率与时间的关系如图所示:

a.CO2的质量分数保持不变
b.容器中N2与CO2的百分含量之比保持不变
c.2v(逆)(NO2)=V(正)(N2)
d.混合气体的颜色保持不变



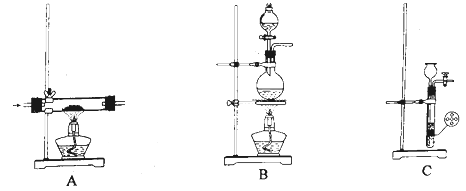
 B . 干燥NH3
B . 干燥NH3  C . 收集NH3
C . 收集NH3  D . 喷泉实验装置
D . 喷泉实验装置 

| 选项 | 实验 | 现象 | 结论 |
| A | 将镁条点燃后迅速伸入充满N2的集气瓶中 | 集气瓶内有黄绿色粉末产生 | N2具有氧化性 |
| B | 向2mLNa2S稀溶液中滴加0.1mol/LZnSO4溶液至不再有白色沉淀产生,然后再往上述溶液中滴加0.1mol/LCuSO4溶液 | 沉淀由白色变为黑色 | Ksp(ZnS)>Ksp(CuS) |
| C | 将镁片和铝片分别打磨后,用导线连接再插入NaOH溶液中 | 片刻后镁片上有大量气泡产生,铝片上产生的气泡很少 | 镁为电池正极 |
| D | 将装有CuCl2∙2H2O晶体的试管加热,在试管口放置湿润的蓝色石蕊试纸 | 试纸变为红色 | CuCl2显酸性 |
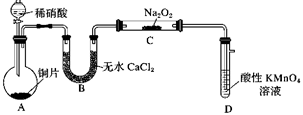
选项 | X溶液 | 固体Y | Z溶液 | 现象 |
|
A | 稀硫酸 | 亚硫酸钠 | 品红试液 | 品红褪色 | |
B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |