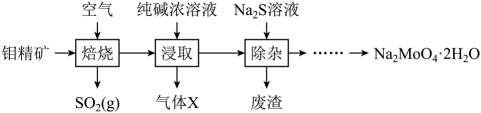
已知:浸取液溶质主要为和
。
①将样品加入水中,得到白色不溶物a和无色溶液
②向①中加入足量稀盐酸,产生气体,仍存在不溶物
该固体粉末一定含有的是


已知:钨酸酸性很弱,难溶于水。25℃时,和
开始沉淀的pH分别为10.3和7.3,完全沉淀的pH分别为8和5。下列说法错误的是

①取少量固体加入足量水中,固体部分溶解;
②取①中滤液做焰色试验,透过蓝色钴玻璃未观察到紫色;
③取①中滤渣,向其中加入足量的盐酸,产生气泡,固体部分溶解.
下列说法错误的是
①向X中加入少量氯水,再滴加淀粉溶液,未显蓝色;
②另取100 mL X加入过量氯水,再滴加足量BaCl2(aq),得到沉淀6.99 g;
③将②反应后的混合液过滤,在滤液中加足量NaOH(aq)加热,生成0.01 mol气体。
根据上述实验,原溶液中( )


下列说法正确的是( )

等产物在化工生产中都有广泛用途。在指定条件下,下列选项所示的物质间转化不能实现的是( )

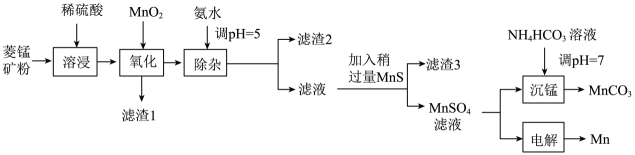
已知25℃时,部分物质的溶度积常数如表所示:
物质 | MnS | NiS | CoS | ||||
说明:整个流程中Co、Ni均为+2价。下列说法正确的是

已知:①一定浓度的金属离子生成相应的氢氧化物沉淀的pH如下表所示,
|
金属氢氧化物 |
开始沉淀时的pH |
完全沉淀时的pH |
|
|
7.6 |
9.6 |
|
|
2.2 |
3.4 |
|
|
4.1 |
5.4 |
②
(无色配离子)
请回答:

①从下列选项中选择合理的仪器和操作,补全如下步骤[“ ”上填写一件最关键仪器,“( )”内填写一种操作,均用字母表示]
蒸馏水洗涤→润洗→( )→装液→( )→( )→用(量取一定体积的)→加指示剂,准备开始滴定。
仪器:a.烧杯;b.酸式滴定管;c.碱式滴定管;d.锥形瓶
操作:e.调整液面至“0”或“0”刻度以下,记录读数
f.橡皮管向上弯曲,挤压玻璃球,放液
g.打开活塞快速放液
h.控制活塞,将洗涤液从滴定管下部放出
i.将洗涤液从滴定管上口倒出
②滴定曲线如下图所示(曲线a未加磷酸,曲线b加磷酸)。滴定操作中向溶液中加入磷酸溶液的原因是:溶液酸化抑制水解、(写出两个理由)。

【实验一】铈量法测定含量。
取25.00 mL试液,用0.1000 mol/L的标准溶液滴定至终点。滴定反应为:
, 4次滴定消耗
溶液的体积如下,
|
实验次数 |
1 |
2 |
3 |
4 |
|
消耗 |
18.75 |
20.05 |
18.70 |
18.65 |
①则该产品中含量为%(保留四位有效数字)。
【实验二】高锰酸钾法测定含量。
取25.00 mL试液,加入适量硫酸,用0.0200 mol/L的高锰酸钾标准溶液滴定至终点。4次滴定测得的含量如下,
|
实验次数 |
1 |
2 |
3 |
4 |
|
|
19.61 |
20.17 |
21.26 |
19.46 |
②比较实验一、二测得的产品中含量,认为铈量法适合于乳酸亚铁中
含量的测定,原因是。
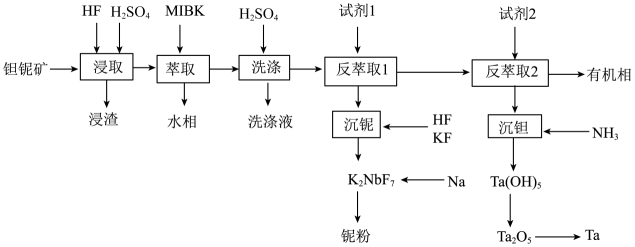
“浸取”后,浸出液中含有两种二元强酸和锰、钛等元素。
已知:①为甲基异丁基酮;②

①流程中钠热还原法制备铌粉的化学方程式为。
②传统的熔盐电解法采用的电解质体系通常为 , 电解总化学反应方程式为。

酸洗时,为使水垢尽可能溶解,不宜选用的是
填标号
.
A.稀硫酸 盐酸
硝酸
醋酸
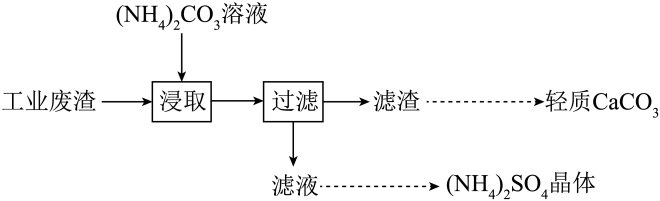
不溶物用碳酸钠溶液浸泡时,反应的离子方程式是 .
洗出液中的
会腐蚀铁质管道,反应的离子方程式是 ,因此,常在洗出液中加入具有强还原性的
溶液,反应中的
与
的物质的量之比为1:2,
转化为
填离子符号
.
柠檬酸
用
表示
可用作酸洗剂,溶液中
、
、
、
的含量与pH的关系如图2所示.图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是
调节柠檬酸溶液的
, 有利于除去水垢中的氧化铁.
时,溶液中上述4种微粒含量最多的是 .


已知几种金属阳离子的氢氧化物沉淀时的pH如下表:
金属阳离子 | ||||
开始沉淀时pH | 1.5 | 3.3 | 6.5 | 5.2 |
沉淀完全时pH | 3.7 | 5.0 | 9.7 | — |
①基态的最高能层中成对电子与未成对电子的数目之比为。
②重铬酸铵常用作有机合成催化剂,
的结构如图。
中
键数目为
。

![]()
已知:①含锌组分间的转化关系:Zn2+Zn(OH)2
②ε−Zn(OH)2是Zn(OH)2的一种晶型,39℃ 以下稳定。
请回答:
仪器: a.烧杯 b.托盘天平 c.容量瓶 d.分析天平 e.试剂瓶


已知:①焙烧时中的Fe元素转化为
, 铝的氧化物转化为
②矿物中相关元素可溶性组分物质的量浓度c与pH的关系如图所示,当溶液中可溶性组分浓度时,可认为已除尽

请回答下列问题:
a.硫酸 b.氢碘酸 c.硝酸钾 d.氢氧化钾

已知:“焙烧”后,碲主要以TeO2形式存在,TeO2溶于强碱生成。
A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.稀硫酸

已知:①高温焙烧后的产物为TeO2和Cu2O;
②Cu2O在酸性条件下会发生歧化反应;
③Te元素在酸化和碱浸后分别转化为TeOSO4和Na2TeO3两种易溶于水的盐。
回答下列问题:
a.离子键 b.配位键 c.氢键 d.σ键



已知:①[Al(OH)4]-+H+ Al(OH)3+H2O,K=1013.38
②NH4VO3的溶解度( g/100g水): 0.48(20℃)、 1.32(40℃)、 2.42(60℃)
回答下列问题:



回答下列问题:
①硫化氢会进一步发生反应 , 计算该反应的平衡常数K=。
②硫代乙酰胺比乙酰胺的沸点低,解释其原因为。
