








在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
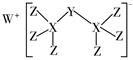
a.x分子的立体构型是,中心原子杂化类型为,属于(填“非极性”或“极性”)分子。
b.X的沸点比水低的主要原因是。
②CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为,共价键的类型有。
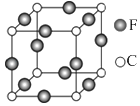
③四方晶系CuFeS2的晶胞结构如图所示。

a.Cu+的配位数为,S2-的配位数为。
b.已知:a=b=0.524 nm,c=1.032nm,Na为阿伏加德罗常数的值,CuFeS2晶体的密度是g·cm-3(列出计算式)。
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6﹣2 | +5﹣3 | ﹣2 | +3 |
Ⅱ如图转化关系A B
C,若B为白色胶状不溶物,则A与C反应的离子方程式为.
根据判断出的元素回答下列问题:

①元素Y与Z中电负性较大的是(用元素符号描述).
②离子ZY32﹣的空间构型为(用文字描述).
③写出一种与ZY2互为等电子体的氧化物分子的化学式.
①基态X2+的电子排布式是.
②1mol配合物K3[X(CN)5(NH3)]中含σ键的数目为.

式或离子方程式.
(I)H2O参与置换反应,符合X+W→Y+V.已知X和Y均是短周期主族元素形成的单
质,W、V是化合物.
①若W是水,且做还原剂,该反应的化学方程式为.
②若V是水,且为还原产物,该反应在常温下进行.发生反应的化学方程式为
(II)A、B是两种由短周期元素组成的有色气体(且MA>MB),它们均能与水发生氧化还原
反应,但水既不是氧化剂也不是还原剂.
①A与H2O反应的化学方程式为,
②气体B通常不是纯净物的主要原因为(用化学方程式表示).

请回答下列问题:

①写出合成该晶体的化学方程式:.
②已知晶体中硼与D原子的最近距离为a pm,则该晶体密度的表达式为 g•cm﹣3 .
(不需化简,阿伏加德罗常数为NA)
