| 时间/min温度/℃ | 0 | 2 | 4 | 6 | 8 | 10 | |
| 容器1 | 200 | 0.80 | 0.55 | 0.35 | 0.20 | 0.15 | 0.15 |
| 容器2 | T | 1.00 | 0.65 | 0.35 | 0.18 | 0.18 | 0.18 |
下列有关该反应的描述正确的是( )
|
实验编号 |
加入0.1 |
加入水的体积/mL |
加入0.1 |
开始出现浑浊所需时间/s |
|
1 |
2 |
0 |
2 |
|
|
2 |
1 |
a |
b |
|
下列说法错误的是( )



选项 | 科技成果 | 解读 |
A | 2021年首次实现As2O3“仿生递送”治疗白血病 | As2O3是两性氧化物 |
B | 北京冬奥会国家速滑馆是应用二氧化碳跨临界直冷制冰技术的大型冰雪运动场馆 | 液态二氧化碳汽化时吸热降温制冰 |
C | 北京冬奥会全部场馆采用光伏发电实现绿色供电 | 光伏发电电池板主要材料是SiO2 |
D | 室温下,在Pt/CoNi催化下实现CO的高效氧化 | 催化剂能加快化学反应速率 |


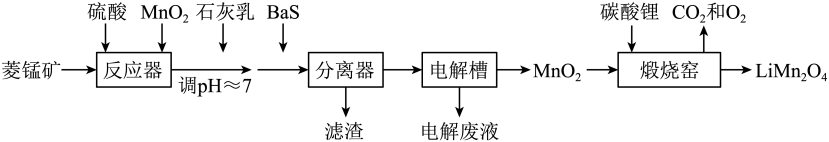
已知:Ksp[Fe(OH)3]=2.8×10-39 , Ksp[Al(OH)3]=1.3×10-33 , Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
编号 | T/K | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (I)实验①和②探究盐酸浓度对该反应速率的影响; (II)实验①和探究温度对该反应速率的影响; (III)实验①和探究锌规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
氢气体积(mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)= (忽略溶液体积变化)。
②反应速率最大的时间段(如0s~10s)为,可能原因是;

①如图可通过观察现象,比较得出比较Fe3+和Cu2+对H2O2分解的催化效果结论。
②某同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是。
| 时间 | | | | | |
| | 0 | 0.50 | 0.65 | 0.75 | 0.75 |
| | 1 | 0.50 | 0.35 | a | 0.25 |
①。
②内,
的平均反应速率
。
③第时
(填“>”“<”或“=”)第
时
。
④下列说法不正确的是(填字母)。
A.按表中数据,处于化学平衡状态
B.使用催化剂可以增大反应速率,提高生产效率
C.恒温恒容,充入氦气可提高反应速率
D.通过调控反应条件,可以改变该反应进行的限度

①实验测得电子由B电极移向A电极,则 (填“A”或“B”)电极入口充入甲醇,B电极的电极反应式为。
②电池放电时,每转移电子,消耗的燃料与氧气质量之比为。
a.是催化剂 b.Zn、
、
构成原电池
c.Zn、Cu、构成原电池 d.上述分析均不正确

②把铁片换为铁粉进行实验,注射器活塞被外推的速度将(填“增大”“减小”或“不变”),说明。
③适当升高烧瓶内液体的温度,注射器活塞被外推的速度将(填“增大”“减小”或“不变”),说明。
④将0.1mol·L-1的稀硫酸换为1mol·L-1的稀硫酸,反应的速率将(填“增大”“减小”或“不变”),若将稀硫酸换为98.3%的浓硫酸,可观察到,原因是。


①M点:正反应速率(填“大于”“小于”或“等于”)逆反应速率。
②内生成丙烯的反应速率为
。
③N点时,。
①
②
其中,在负极上发生的反应是(填“①”或“②”)。

①降低温度,化学反应速率;
②充入少量不参加反应的稀有气体,化学反应速率;
③将容器的体积压缩至原来的一半,化学反应速率。
| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
|
| 0.020 | 0.012 | 0.008 | 0.005 | 0.004 | 0.004 |
①0~4 s内,。
②反应达到平衡后,下列改变一定可以使该化学反应速率增大的是。
a.缩小容器体积 b.升高温度
c.恒容条件下通入氢气 d.恒容条件下通入氦气
③在第5 s时,B的转化率为。
④平衡时,容器中混合气体的压强与反应开始时的压强之比为。
①该反应中元素被氧化,氧化剂是(用化学式表示,下同),还原产物为。
②当反应中有1 mol离子生成时,转移的电子数是
。
①为降低反应进行的速率,又不影响生成氢气的量,可向反应物中加入。(填序号)
A.固体 B.
固体 C.
溶液 D.
溶液
②向溶液中滴加少量硫酸铜溶液,反应速率加快,原因是。

下列说法中能够判定该反应处于平衡状态的是。(填序号)。
A.速率 B.气体的总质量不再变化
C.气体的颜色不再变化 D.M的体积分数不变

不能说明该反应已达到平衡状态标志的是(填标号)。
a.体系温度不变
b.反应速率5v(NH3)消耗 =4v(N2)消耗
c.容器内压强不再随时间而发生变化
d.容器内N2的物质的量分数不再随时间而发生变化
e.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO2) /mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是。该温度下,反应2NO2(g) N2O4(g)的平衡常数K=L·mol-1。

一定温度下,k1、k2与平衡常数KP的关系是k1=。在图标出的点中,指出能表示反应达到平衡状态的点并说明理由。