
| 选项 | 操作 | 现象 | 解释、结论 |
| A | 用玻璃棒蘸取浓氨水点到干燥红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | 向蔗糖中加入浓硫酸并搅拌 | 蔗糖变黑,体积膨胀 | 反应中浓硫酸只体现脱水性 |
| D | 过量的Fe粉与氯气充分反应后,向反应后的混合物中加水,取上层清液滴入KSCN溶液 | 溶液不变红色 | 氯气将Fe氧化为Fe2+ |
 B . 用装置②检验和收集SO2
B . 用装置②检验和收集SO2  C . 用装置③稀释反应后溶液
C . 用装置③稀释反应后溶液  D . 用装置④测定反应后溶液中c(H+)
D . 用装置④测定反应后溶液中c(H+) 
实验装置 |
|
|
|
|
实验目的 | 实验验证浓硫酸具有脱水性、氧化性 | 制取并收集少量氨气 | 验证NaHCO3和Na2CO3的热稳定性 | 采用CCl4萃取I2 |
A | B | C | D |
| 选项 | 现象 | 解释 |
| A | 蔗糖变黑 | 浓硫酸具有脱水性 |
| B | 有刺激性气味 | 浓硫酸具有强酸性 |
| C | 固体体积膨胀 | 生成大量气体 |
| D | 烧杯壁发烫 | 反应放热 |
操作 | 结论 | |
A | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
B | 分别加入到盛水的试管中 | 剧烈放热者为浓硫酸 |
C | 取等体积样品,称量质量 | 质量大者为浓硫酸 |
D | 分别滴在火柴梗上 | 变黑者为浓硫酸 |

| 选项 | 实验操作和现象 | 结论 |
| A | 某溶液 | 原溶液中一定含有CO32- |
| B | 用湿润的pH试纸测某碱液的pH,测定值偏小 | 湿润的pH试纸测量任何溶液都会产误差 |
| C | 将浓硫酸倒入蔗糖中搅拌蔗糖迅速变黑并伴有刺激性气味 | 浓硫酸具有脱水性和强氧化性 |
| D | 将乙烯和苯分别加入到溴水中,都能使溴水层褪色 | 乙烯和苯分子中都含有碳碳双键 |
实验 | 结论 | |
A | 将金属钠在燃烧匙中点燃迅速伸入集满 |
|
B | 将打磨过的铝条放入试管,再加入 | 铝与浓硫酸常温下不反应 |
C | 将稀硝酸加入过量铁粉中,充分反应后再滴加 |
|
D | 向鸡蛋白溶液中加入饱和 | 蛋白质发生了变性 |

请回答:
组成X的四种元素是N、H和(填元素符号),X的化学式是。
①其中一种反应物的组成元素必须是X中除N、H外的两种元素;
②反应原理与“ ”相同。

将浓硫酸和浓盐酸混合可产生 气体的原因是。

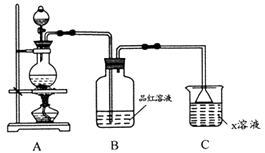
①装置连接顺序:x→;
②能证明上述假设成立的实验现象是。
![]()
写出产生该灰白色悬浮物主要反应的化学方程式。
 量取浓硫酸
B .
量取浓硫酸
B .  稀释浓硫酸
C .
稀释浓硫酸
C .  转移入容量瓶
D .
转移入容量瓶
D .  定容
定容
①浓硫酸的吸水性:各取0.5g胆矾颗粒于试管中,分别加入3mL不同浓度的硫酸。
②浓硫酸的脱水性:各取一根木柴梗于试臂中,分别加入1mL不同浓度的硫酸。
③浓硫酸的钝化:各取约1cm经过砂纸打磨过的铁丝,再向试管中加入3mL不同浓度的硫酸。
实验结果见下表:
实验 | c(H2SO4)/mol/L | 18.4 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 1-5 |
① | 胆矾颜色变化 | 蓝一白 | 蓝一白 | 蓝一白 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 |
② | 木柴梗颜色变化 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 不变 |
③ | 铁丝表面气泡 | 无 | 无 | 有 | 有 | 有 | 有 | 有 | 有 | 有 |
结合表格数据回答下列问题:
用化学方程式表示胆矾由“蓝一白”的原因:;当硫酸的浓度≥mol/L时即具有脱水性。
在试管中分别加入1小块铜片,再向试管中分别加入2mL 不同浓度的硫酸,用下图所示的装置进行实验。(夹持仪器略去)

①b装置的作用是
②本实验中证明浓硫酸具有强氧化性的现象是、。
③试管a中加热时产生黑色的固体,经检验该黑色固体中含有Cu2S。写出生成该物质的化学方程式.
④经过实验发现:c(H2SO4)≥ 6mol/L时,硫酸与铜在加热反应时即可表现强氧化性。有同学预测,铜片与5mol/L的硫酸在长时间持续加热时,也会发生反应。该预测的理由是.
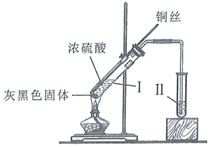
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验: 
实验Ⅱ:反应产物的定量探究
(已知2Cu2++4I﹣=2CuI+I2 , 2S2O32﹣+I2=S4O62﹣+2I﹣)

实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面.
请回答下列问题:
滴加的溶液 | 氯水 | 氨水 |
沉淀的化学式 |
写出其中SO2表现还原性的离子反应方程式:.
Ⅰ.方法一:

实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌.
实验现象:;
实验结论:所得白色固体的化学式为.
丙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2 2CuO,CuO+H2SO4═CuSO4+H2O.对比甲的方案,你认为丙同学的优点是①,②.
丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色.写出反应的化学反应方程式.

编号 | 实验用品 | 实验现象 | |
① |
| 过量铜片 | 剧烈反应,品红溶液褪色, |
② |
| 适量铜片 | 剧烈反应,品红溶液褪色, |
【资料】①微量与过量
溶液发生反应:
,
溶于甘油形成特征的绛蓝色溶液。
②和
均为黑色固体。
回答下列问题:
实验Ⅰ:将含黑色固体的铜片取出放入到试管中,加入稀硫酸搅拌,充分反应后加入过量的溶液,再滴入几滴甘油,无明显现象;
实验Ⅱ:将含黑色固体的铜片取出放入到试管中,加入溶液X并加热,一段时间后,黑色沉淀全部溶解,试管口处出现红棕色气体,底部有淡黄色固体生成。
①实验Ⅰ说明黑色固体中(填“含有”或“不含有”)。
②实验Ⅱ中“溶液X”是,实验证明固体为或
。
取样:铜元素
, 硫元素
。
取样:铜元素
, 硫元素
。
则时黑色沉淀的成分是。

为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊。(已知淀粉溶液遇I2变蓝)

①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b
③打开止水夹a和c,关闭止水夹b
I.将光亮铜丝插入浓硫酸,加热;
II.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
III.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
查阅文献:检验微量Cu2+的方法是:向试液中滴加溶液,若产生红褐色沉淀,证明有Cu2+。
①将CuO放入稀硫酸中,一段时间后,再滴加溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,滴加溶液,未见红褐色沉淀。由该检验过程所得结论是:该黑色沉淀CuO(填写“含有”或“不含”)
|
实验装置 |
现象 |
|
|
1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
①现象2说明黑色沉淀具有性(填写“氧化性”或“还原性”)
②请写出在试管上方由无色气体转变为红棕色气体的化学方程式。
③能确认黑色沉淀中含有S元素的现象是。
④为确认黑色沉淀是否含有二价铜,需要进行的实验是。
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是(填序号);

试回答下列问题:
①图1的A中最好选用下列装置(填编号);

②图1的 B装置所装试剂是;D装置中试剂的作用是;E装置中发生的现象是;
③图1的A装置中使蔗糖先变黑的化学反应方程式为,后体积膨胀的化学方程式为:;
④某学生按图进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因,其反应的离子方程式是。
A BaCl2溶液 B 铁粉 C NaHCO3溶液 D 银粉


A中反应的化学方程式为。
i. 将光亮铜丝插入浓硫酸,加热;
ii. 待产生黑色沉淀和气体时,抽出铜丝,停止加热;
iii. 冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
查阅文献:检验微量Cu2+的方法是向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+。
该同学假设黑色沉淀是CuO。检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,未见红褐色沉淀。由该检验过程所得结论:。
|
实验装置 |
现象 |
|
| 1. A试管中黑色沉淀逐渐溶解 2. A试管内上方出现红棕色气体 3. B试管中出现白色沉淀 |
①现象2说明黑色沉淀具有性。
②能确认黑色沉淀中含有S元素的现象是,相应的离子方程式是。
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是。
铝制品表面有一层氧化铝薄膜而经久耐用,但该氧化膜易被酸、碱破坏,现要将氧化铝与氢氧化钠溶液作用,写出该反应的离子方程式:
Ⅰ根据右图所示装置,回答下列问题.

停止反应后,b处产生的现象是:;
写出a处发生反应的化学方程式:;
蘸有 溶液的棉花的作用是:;

若原料气的流向为从左到右,则上述装置连接的顺序是(填字母代号):原料气 →→→→→e;已知装置Ⅱ中反应为: .当装置Ⅱ中出现现象时,立即停止同期.若
溶液的浓度为0.05
,体积为20mL,此时收集到的
与
的体积为297.6mL(已经折算为标准状况下的气体体积),由此可求得
的体积分数为.