X | Y | |
Z | W |

①高温熔融:
②酸化:
③加碘化钾滴定:、
若皮革样品质量为 , 滴定过程共消耗
的
。下列说法正确的是( )
物质 | 用途 |
A.碳酸氢钠 | a.作膨松剂 |
B.浓硫酸 | b.作制冷剂 |
C.液氨 | c.作红色涂料 |
D.氧化铁 E.过氧化钠 | d.作供氧剂 e.作干燥剂 |
物质 | 用途 |
A.铝 | a.制合金 |
B.过氧化钠 | b.作供氧剂 |
C.碳酸氢钠 | c.作红色颜料 |
D.氧化铁 | d.作食用碱 |
物质 用途
A.过氧化钠 a.做红色颜料
B.食盐 b.做调味品
C.氧化铁 c.用于烘焙糕点
D.碳酸氢钠 d.用于供氧剂
D→c,A→,B→,C→。
①焙烧时为加快反应速率,可采取的措施是。
②生成的化学方程式如下,将其补充完整:。
□+□
□_+□
+□

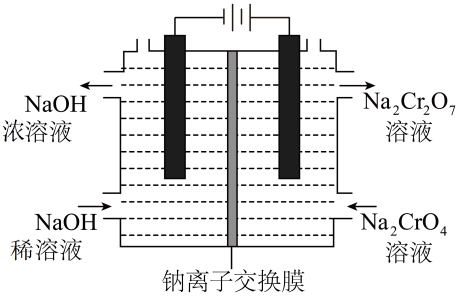
①结晶时,将混合溶液加热浓缩、(填操作)、冷却结晶、过滤得到红矾钠晶体。
②滤液5最适宜返回上述流程中,参与循环再利用。
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0 g铁屑,加入15 mL 10% Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1 g。
步骤二:将步骤一中的m1 g固体转移至锥形瓶,加入15 mL 3 mol·L-1 H2SO4 , 加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2 g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500 ℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

B装置的作用是
|
实验步骤 |
预期现象 |
结论 |
|
①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡便其完全溶解; ②将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 |
|
固体残留物仅为Fe2O3 |
Ⅰ.制备K2FeO4装置如图所示,夹持、加热等装置略。

准确称取1.00g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O , 滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol•L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00mL。
根据以上数据,样品中K2FeO4的质量分数为。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果(填“偏高”“偏低”或“无影响”)。

①基态的核外电子排布式为。
②Cu转化为的离子方程式是。
③该步骤中实际用量超过理论用量的原因是。
①该反应的离子方程式为。
②通过调节溶液的pH使生成
沉淀也可达到除铁的目的。加入
“除铁”的优点是。
步骤1:称取3.540 g样品,加水溶解配成100.00 mL溶液A,取20.00 mL溶液A,加入一定量稀硫酸酸化后,用标准溶液滴定至终点,共用去
标准溶液标准溶液16.00 mL。
步骤2:向步骤1滴定后所得溶液中加入过量KI溶液,充分反应。加入淀粉指示剂,用
标准溶液滴定至终点,共用去
标准溶液20.00 mL。
实验过程中发生如下反应:
通过计算确定该样品的化学式(写出计算过程)。