


①朴素理论:与酸作用时失去它原来的性质,而且能使商酞试液变红的物质一定是碱
②电离理论:能够在水溶液中产生氢氧根离子的化合物就是碱。
③经验理论:有涩味的物质就是碱。
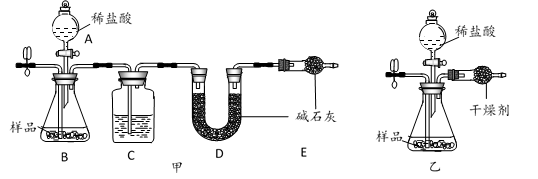
选项 | 实验装置 | 反应开始前鼓入的气体 | 反应结束后鼓入的气体 |
A | 甲 | 氮气 | 氮气 |
B | 甲 | 干燥空气 | 干燥空气 |
C | 乙 | 氮气 | 氮气 |
D | 乙 | 干燥空气 | 干燥空气 |
[建立猜想]①固体为CuCO3;②固体为Cu(OH)2;③固体为Cu(OH)2和CuCO3的混合物。
[设计实验]已知:Cu(OH)2、CuCO3受热易分解[Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃﹣220℃],各生成对应的两种氧化物。
步骤1:将烧杯中的混合物进行过滤,并对蓝色固体进行洗涤、低温烘干;
步骤2:取一定量的蓝色固体,用如图乙所示装置和药品,定性分析其成分;
步骤3:另取一定量的蓝色固体,用热分析仪对其进行热分解,定量测定其成分。


①白色沉淀E是 。
②小明认为由探究二可以确定该化肥中一定混进了NH4Cl和(NH4)2SO4、一定没有K2CO3 , 小强认为这个结论不正确,请说明原因并写出你的改进方案 。
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| 1 | 取少量凝固剂溶液于试管中,加入几滴无色酚酞试液 | 仍为无色溶液 | 凝固剂中不含① |
| 2 | 再取少量凝固剂溶液于试管中,加入过量的硝酸钡溶液 | 有②产生 | 凝固剂中含有硫酸钠 |
| 3 | 取实验2中的适量滤液于试管中,加入适量的AgNO3溶液和稀HNO3 | 有白色沉淀 | 凝固剂中含有氯化钠 |


取12克食用碱样品放入锥形瓶进行实验。按定量测定实验的正确步骤,进行规范操作,并用电子天平对某一装置进行连续称重,直至该装置质量不再改变时停止实验,此时该装置质量增加了4.4克。(假设每步吸收都完全,ACDE装置中试剂均过量)
回答下列问题:

资料一:氯化铜溶液中的Cu2+会与H2O、Cl-相结合,分别形成呈蓝色物质1和呈黄色物质2。Cu2+与H2O、Cl-相结合的数量会随着氯化铜溶液浓度的改变而发生变化,从而使呈蓝色物质1和黄色物质2的数量发生变化。
资料二:根据光学原理,颜色可调。例如:蓝色+黄色=绿色。
请解释原因: