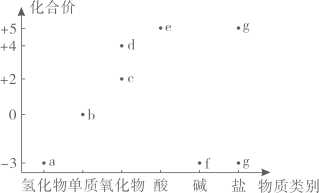

①
②
在一定条件下模拟处理氨氮废水:将的氨水分别和不同量的
混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与
投入量(用x表示)的关系如下图所示。下列说法正确的是








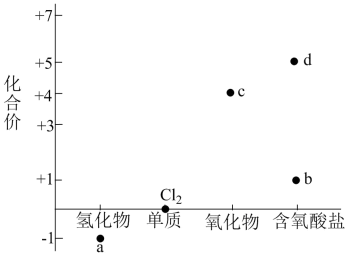
下列说法错误的是( )

A | B | C | D |
|
|
|
|
制取氯气 | 验证氧化性 | 验证漂白性 | 吸收尾气 |

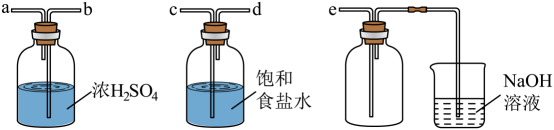
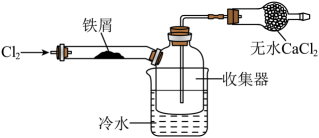
①下列操作步骤的正确顺序为(填字母)。
a.体系冷却后,停止通入 b.通入干燥的
赶尽装置中的空气
c.在铁屑下方加热至反应完成 d.用干燥的赶尽
e.检验装置的气密性
②该实验装置存在的明显缺陷是。
已知: ,
。
有关物质的熔、沸点如下表:
物质 | 熔点/℃ | 沸点/℃ |
-59 | 11 | |
-107 | -34.6 |
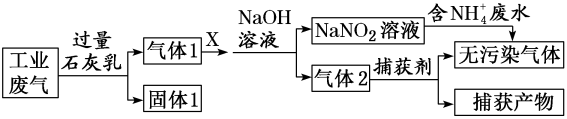
的生产流程示意图如下:

该工艺中,需要补充的物质X为(填化学式,下同),能参与循环的物质是。从发生器中分离出
, 可采用的方法是。

ⅱ.随着反应进行,……
[进行实验]将反应后的固液混合物倒出,平均分在2个试管中,分别进行以下实验,证实了猜想ⅰ不成立。
|
序号 |
实验操作 |
实验现象 |
|
Ⅰ |
将湿润的淀粉碘化钾试纸放置于试管口,加热试管;,充分振荡,继续加热 |
试纸未变蓝 |
|
Ⅱ |
将湿润的淀粉碘化钾试纸放置于试管口,加热试管;滴入2滴浓硫酸,充分振荡,继续加热 |
滴入浓硫酸前,试纸不变蓝;滴入浓硫酸后,试纸变蓝 |
将Ⅰ中操作补充完整:
序号 | 实验装置 | 实验操作 | 现象 |
Ⅲ |
| 向左侧烧杯中滴加2滴浓硫酸 | 滴加浓硫酸前,电流表指针不偏转;滴加浓硫酸后,电流表指针偏转 |
Ⅳ | 向右侧烧杯中滴加2滴浓硫酸 | 电流表指针始终不偏转 |
滴加浓硫酸后,左边烧杯中反应的电极反应式是。
序号 | 实验操作 | 实验现象 |
Ⅴ | 在0.5g二氧化锰中加入2毫升5%双氧水 | 产生气泡 |
Ⅵ | 在0.5g二氧化锰中滴加2滴浓硫酸,再加入2毫升5%双氧水 | 产生气泡,黑色固体消失,生成无色溶液 |
Ⅵ中反应的离子方程式是。
a.IBr中溴为﹣1价 b.HBr、HI的酸性
c.HBr、HI的热稳定性 d.Br2、I2的熔点
MBr | NaBr | KBr | RbBr | CsBr |
熔点/℃ | 747 | 734 | 693 | 636 |
NaBr的电子式,MBr熔点呈现表中趋势的原因是。
①该反应的离子方程式为。
②增大废水的 , 除生成
沉淀和
沉淀外,还可能生成另一沉淀的化学式为。

①时发生反应的离子方程式为。
②废水的对氨氮去除率的影响如图-2所示。氨氮去除率在
后迅速下降、
后下降变缓,其原因可能是。

已知:本实验条件下,氧化性:Cl2>IO>MnO2>I2
回答下列问题:

①实验室用装置A制备Cl2时,适合选用的试剂为。
②实验时,控制向装置B中通入Cl2的速率和用量的常用方法为,若Cl2过量,造成的后果为(用离子方程式表示),向通入过量Cl2所得的溶液中加入一种试剂,可提高I2的产率,该试剂为(填选项字母)。
a.KI b.NaOH c.硝酸
③若用MnO2代替Cl2 , 优点是,(答出一点即可);缺点是分离出的固体残渣中含有少量I2。小组同学用如图3所示装置进行固体残渣中I2的深度萃取,实验时装置D中溶剂受热蒸发,蒸汽沿蒸汽导管上升至装置F,冷凝后滴入滤纸套筒中,与固体残渣接触进行萃取,液面达到虹吸管顶端时,经虹吸管返回烧瓶。装置F的进水口为(填“上口”或“下口”),与常规萃取相比,该萃取装置的优点为。
①铝土矿中 的晶体类型;
②比较 的简单离子半径大小;
③ 最外层电子的电子云形状为。