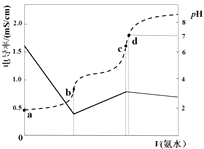
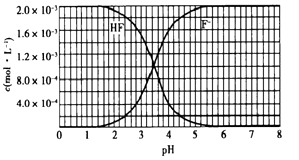
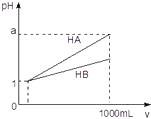
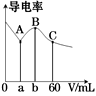
6.
(2018·沈阳模拟)
亚砷酸(H
3AsO
3)可用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L
-1 H
3AsO
3溶液中逐滴加入0.1mol·L
-1KOH溶液,各种微粒物质的量分数与溶液的pH关系如下图所示。下列说法正确的是( )

A . H3AsO3的电离常数Ka1的数量级为10-9
B . pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O
C . M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1
D . pH=12时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+)