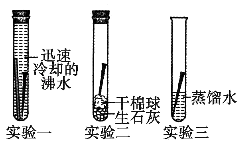
B . 检查装置气密性
B . 检查装置气密性  C . CO2 验满
C . CO2 验满  D . 比较材料硬度
D . 比较材料硬度 

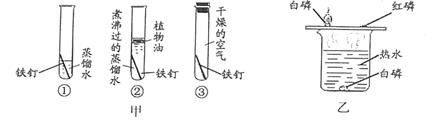
比较硬度,硬度小的是“愚人金”
灼烧,表面变色的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
选项 | 物质(括号内为杂质) | 方法 |
A | N2(O2) | 将混合气体通过灼热铜网 |
B | Fe粉(炭粉) | 加入足量稀H2SO4充分反应,过滤、洗涤、干燥 |
C | CaO(CaCO3) | 高温煅烧 |
D | FeCl2溶液(CuCl2) | 加入足量Fe粉,过滤 |

①Mg2+ ②Mg2+和Fe2+ ③Fe2+和Cu2+ ④Mg2+、Fe2+和Cu2+
①若滤液为蓝色,则滤渣中一定不含锌和M
②若滤液只含一种溶质,滤渣含四种金属,则几种金属活动性顺序:M>锌>铜>银
③若滤渣含有M,则滤液中的溶质种类最多含3种,最少含一种
④向滤渣中加入稀盐酸产生无色气体,则滤渣中一定含锌,可能含M
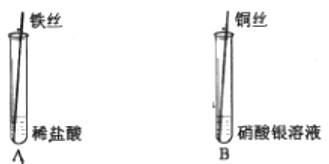
①A中观察到铁丝表面;
②B中发生反应的化学方程式为,该实验过程中可观察到的现象有
a.冒气泡
b.出现海绵状银白色固体
c.铜丝表面变黑
d.无色溶液变为蓝色
③为达到实验目的,还需补充一个实验(写成所需试剂化学式)。
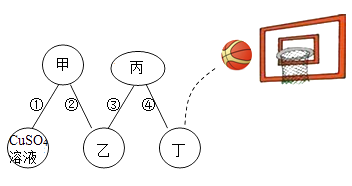
回答下列问题:

请你在横线上填写对应金属的元素符号。
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
|
实验 |
试管1 |
试管2 |
试管3 |
|
实验操作 |
| | |
| 实验现象 | 铁片表面产生气泡较慢,溶液变成色 | 铬片表面产生气泡较快,溶液变成为蓝色 | 无明显现象 |
【结论与解释】
①小聪得到的结论是猜想正确。
②实验前用砂纸打磨金属片的目的是。
①将铬片投入FeSO4溶液中,反应(填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式。
②铬片与铜片互相刻划时,在的表面可留下划痕,可以比较出这两种金属的硬度。
③向AgNO3和Cu(NO3)2的混合溶液中加入过量铬粉,充分反应后过滤,滤渣中一定含有。
[提出问题]在高温的条件下,CO能还原ZnO和Fe2O3混合粉末吗?

[设计实验] 实验后,为证明玻璃管中的粉末是Zn和Fe,请你设计下列两个实验:

[反思交流]
①实验1:反应的化学方程式可能是③;
②实验2:观察到的现象是:粉末消失,溶液的颜色④;
③在上述CO还原ZnO和Fe2O3混合粉末装置中,为节省燃料,请你提出在原装置基础上的一种改进方法是⑤;