| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 硝酸将Fe2+氧化为Fe3+ |
| B | 将铜粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属铁比铜活泼 |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D | 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成,后变为浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
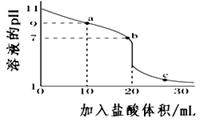
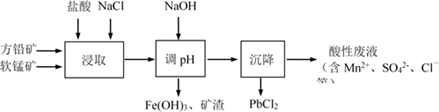
已知:i. PbCl2微溶于水
ii. PbCl2 (s) + 2Cl-(aq) PbCl42-(aq) ΔH > 0
下列说法不正确的是( )
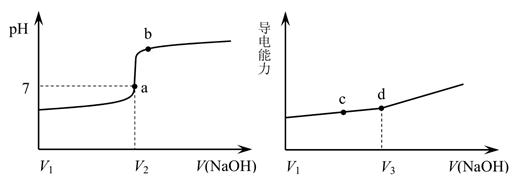
(已知:Ksp(ZnS)=3×10-25mol2/L2)
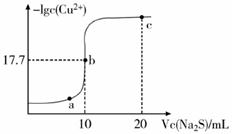

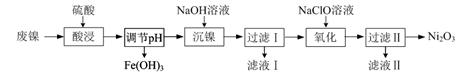
O2氧化MnO(OH)的化学方程式是。
① 溶液a呈酸性,原因是。
② 根据下图所示的溶解度曲线,将溶液a (填操作名称),可得NH4Cl粗品。
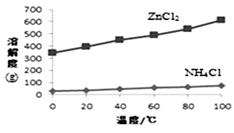
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ |
根据上表,设计方案提纯NH4Cl:
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4 , 固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4 , 固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:。
② 解释试剂加入顺序不同,MnO2作用不同的原因:
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
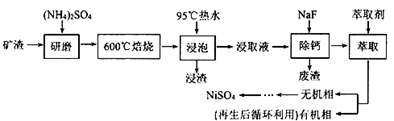
已知(NH4)2SO4在350℃分解生成NH3和H2SO4 , 回答下列问题:

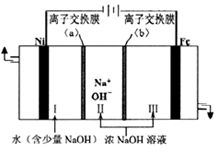
图甲 图乙
①电解时阳极的电极反应式为,离子交换膜(b))为(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为。

上述盐溶液中的阴离子,结合质子能力最强的是。
A.HCN B.HClO C.H2CO3 D.CH3COOH
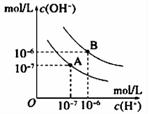
95℃时水的电离平衡曲线应为(选填“A”或“B”);
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式:。
方法一:在恒容密闭容器中将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
①下列条件可以判定该反应到达平衡状态的是(填字母)。
A.2v正(H2)=v逆(CH3OH) B.容器内气体的密度不变
C.容器内压强不变 D.反应不再释放热量
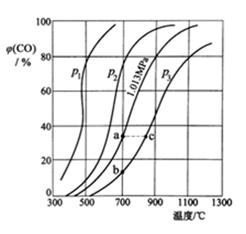
方法二:让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) 2CO(g) ∆H,测得压强、温度对CO的体积分数[φ(CO)%]的影响如图所示,回答下列问题:
② 图中p1、p2、p3的大小关系是,图中a、b、c三点对应的平衡常数Ka、Kb、Kc大小关系是。
③ 900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V L,CO2的转化率为(保留一位小数),该反应的平衡常数K=。
方法三:用NaOH溶液吸收CO2。
④在NaOH溶液中通入一定量的CO2气体,所得溶液中c(HCO32-):c(CO32-)=4:1,此时溶液的pH=。(已知:室温下,H2CO3的K1=4×10-7 , K2=5×10-11。lg2=0.3)