



丙-戊反应能产生一种气体。且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )

| 甲 | 乙 | 丙 | 丁 | 戊 | |
| A | 铁 | 硝酸银 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
| B | 硝酸银 | 铁 | 稀盐酸 | 氢氧化钡 | 碳酸钙 |
| C | 硝酸银 | 铁 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
| D | 铁 | 氢氧化钡 | 碳酸钙 | 硝酸银 | 稀盐酸 |
 B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 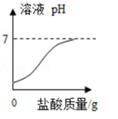


| 甲 | 乙 | 丙 | 丁 | 戊 | |
| A | 铁 | 硝酸银 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
| B | 硝酸银 | 铁 | 稀盐酸 | 氢氧化钡 | 碳酸钙 |
| C | 硝酸银 | 铁 | 碳酸钙 | 氢氧化钡 | 稀盐酸 |
| D | 铁 | 氢氧化钡 | 碳酸钙 | 硝酸银 | 稀盐酸 |
| 加入的物质 | 酚酞试液 | Fe2O3粉末 | BaCl2溶液 |
| 实验现象 | 无明显现象 | 固体逐渐溶解,溶液变黄 | 无明显现象 |


①金属表面除锈;②除去氯化钠中少量的氢氧化钠;③实验室制取二氧化碳。

①铁 ②碳酸钠 ③氧化铁 ④氢氧化镁



|
实验内容 |
实验现象 |
分析与结论 |
|
| 两试管中均产生气泡 | ⑴不同的酸具有相似的性质,这是因为酸的溶液中都含有(填离子符号) |
| | E试管中产生,F试管中无明显现象 | ⑶不同的酸根会导致酸的“个性差异”。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
⑴废液缸中产生气体的化学方程式为。
⑵废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有(填化学式)。
它们都能除铁锈,将带锈迹的铁钉放入过量的盐酸中,首先看到锈迹溶解,溶液呈色。不一会儿,又看到溶液中有气泡产生,这是因为(用化学方程式表示):。

①稀释浓硫酸时,应将缓缓地注入盛有的烧杯中并不断搅拌;
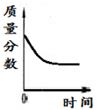
②由如图曲线你能得到的实验结论有哪些?
(写两点)、.
|
实验步骤 |
实验操作 |
实验现象 |
|
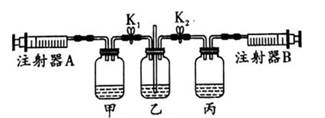
① |
打开K1 , 关闭K2 , 缓慢拉注射器A活塞 |
甲中液面上方无明显现塁_ |
|
② |
打开K2 , 关闭K1 , 缓慢拉注射器B活塞 |
丙中液面上方出现大量白烟 |
【提出问题】烧碱样品中含有哪些杂质?
【建立猜想】猜想1:可能含有碳酸钠,判断依据是氢氧化钠能和二氧化碳反应生成碳酸钠。
猜想2:可能含有氯化钠,判断依据是在化工生产中,原料可能。
【实验探究】
|
实验操作 |
实验现象 |
实验结论 |
|
取少量烧碱样品于试管中,加适量水溶解,加入过量的稀硝酸,再滴加少量硝酸银溶液 |
|
烧碱样品中含有碳酸钠和氯化钠 |
【反思评价】除去烧碱样品中含有的少量碳酸钠,可选用的药品是。
A.CuCl2溶液 B.Ba(NO3)2溶液 C.Ba(OH)2 溶液 D.KOH溶液