
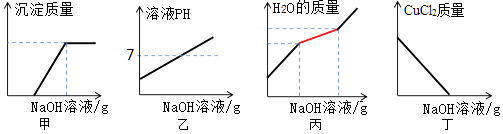





选项 | 甲 | 乙 | 纵坐标 y |
A | 硝酸铜与硝酸银的混合溶液 | 锌粉 | 红色固体质量 |
B | 氯化铁与稀盐酸的混合溶液 | 氢氧化钠 | 沉淀质量 |
C | 不饱和氯化钠溶液 | 硫酸钾 | 溶质质量分数 |
D | 久置于空气中的氢氧化钠溶液 | 稀盐酸 | 气体质量 |
实验操作 | 实验现象 |
取该固体于试管中,加水、振荡 | 固体不溶解 |
取该固体于试管中,加盐酸、振荡 | 固体溶解,无气泡产生 |
一氧化碳通过炽热的该固体, 称固体质量、检测尾气 | 固体质量减轻,尾气中只检测到 CO 与 CO2 |
①将固体样品溶于水得无色透明溶液,加入足量 BaCl2 溶液过滤,得到白色沉淀和无色滤液。
②在①所得的白色沉淀中加入过量稀硝酸,白色沉淀部分溶解并产生气泡。
③在①所得的无色滤液中滴加 AgNO3溶液产生白色沉淀。
由此推断该固体中一定含有的离子是( )

加入的物质 | Na2CO3溶液 | Cu(OH)2固体 | BaCl2溶液 |
实验现象 | 有气泡产生 | 固体溶解 | 白色沉淀 |

| 选项 | 实验室中的废液或废物 | 溶质a |
| A | 剩余的表面已经被氧化的铝片 | H2SO4 |
| B | 氢氧化铜和过量稀盐酸反应后的溶液 | NaOH |
| C | 稀硫酸与过量氢氧化钠溶液反应后的溶液 | BaCl2 |
| D | 碳酸钠溶液和氢氧化钙溶液恰好完全反应后的混合物 | HCl |

①往镁粉和氧化铜的混合物中加入过量稀硫酸,充分反应并过滤,得到滤渣甲和滤液A;
②往滴有无色酚酞的氢氧化钠和硝酸钡的混合溶液中,加入一定量的稀硫酸,充分反应并过滤,得到沉淀乙和无色滤液B;
③将滤液A和B充分混合后,得到沉淀丙和滤液C; ④往滤液C中滴加氯化钡溶液,没有沉淀产生。
回答下列问题:


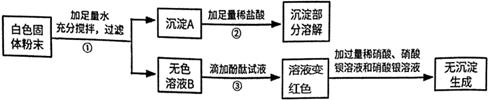

根据上述实验现象判断:
白色固体中一定不含,一定含有,可能含有;
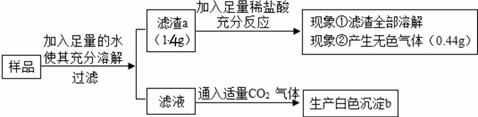
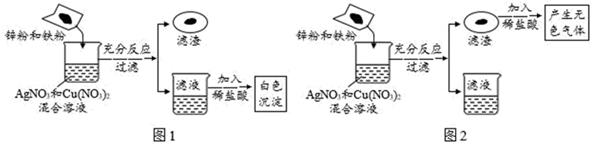
①滤液中一定含有的金属离子为(填离子符号)
②写出一个产生滤渣的反应的化学方程式.
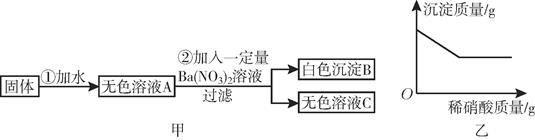
①滤渣中一定含有(填化学式,下同)
②滤液中可能含有.

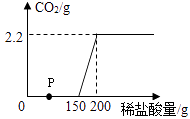
试分析计算回答:
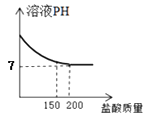 B .
B . 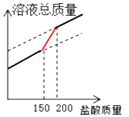 C .
C . 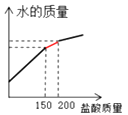 D .
D . 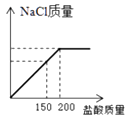
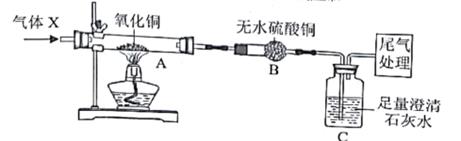
②铜和氧化亚铜均为不溶于水的红色固体;③Cu2O+H2SO4=CuSO4+Cu+H2O
小乐为了探究反应所得红色固体的成分,进行了如下实验: .
|
实验操作 |
|||
|
步骤一 |
取20g红色固体于烧杯中,加入足量稀硫酸 |
|
红色固体可能是氧化亚铜,也可能是铜和氧化亚铜 |
|
步骤二 |
将步骤一反应所得的混合物经过滤、洗涤、干燥并称量剩余红色固体质量 |
剩余红色固体质量为12g |
20g红色固体中,铜和氧化亚铜的质量比为 |
| 装置 | 反应前 | 反应后 |
| A | 试管的质量36.2 克 氧化铜和炭粉混合物的质量20.0克 |
试管和固体物质的质量54.8 克 |
| B | 反应后瓶内液体比反应前增重1.1 克 | |
分析数据发现,反应中消耗碳和氧元素的质量大于生成二氧化碳的质量.下列4项中跟这一结果有关的有哪几项? (填编号)
【提出问题】该滴瓶中溶质的成分是什么?
猜想Ⅰ溶质成分只有:KCl; 猜想Ⅱ溶质成分为:KCl和KOH;
猜想Ⅲ溶质成分为:KCl、K2SO4; 猜想Ⅳ溶质成分为:KCl、KOH和K2SO4 .
【实验探究】为证明猜想,小军设计了如下实验方案,请你一起完成下列实验报告;
|
实验操作 |
实验现象 |
结论或解释 |
|
(1)取该滴瓶内溶液于试管中,向试管中加入适量BaCl2溶液 |
|
溶质中有K2SO4 |
|
(2)将上述反应后的混合液过滤,取滤液于另一支试管中,向该试管中加入酚酞试液 |
|
证明猜想Ⅳ成立 |
[猜想与假设]猜想I;白色粉末是碳酸钠。
猜想Ⅱ:白色粉末是氢氧化钠。
猜想Ⅲ:白色粉末是。
[查阅资料]CaCl2溶液、Ca(NO3)2溶液呈中性。
[实验探究]取白色粉末溶于水形成溶液A,设计如下实验:

⑴由上述实验可知,猜想肯定不成立。
⑵适合操作③的X溶液是(填字母序号)。
A.CaCl2溶液 B.Ca(OH)2溶液 C.Ba(OH)2溶液
⑶操作④需要用到的一种玻璃仪器。
