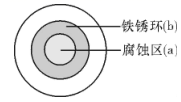
| ① | ② | ③ |
| | | |
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法错误的是( )
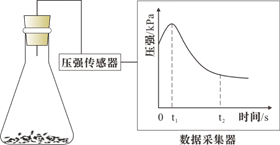
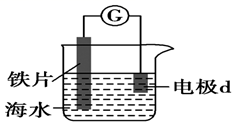

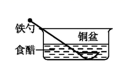 B .
B . 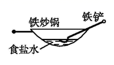 C .
C . 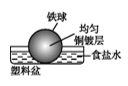 D .
D . 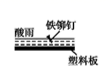
① 向极移动(填“正”或“负”)。
②若有 流过导线,则理论上负极质量减少g。
③若将稀硫酸换成浓硝酸,其负极的电极方程式为:。
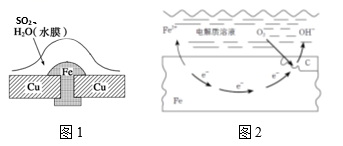
A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀