| 选项 | 家务劳动 | 化学知识 |
| A | 将切过咸菜的钢制刀具洗净并擦干 | 减缓钢铁的电化学锈蚀 |
| B | 给花木施肥时,草木灰不与硝酸铵共施 | 草木灰与硝酸铵反应造成肥效降低 |
| C | 用温热的纯碱溶液清洗厨具油污 | 油脂在热的纯碱溶液中更易发生水解 |
| D | 用富含淀粉的谷物酿酒 | 淀粉水解为葡萄糖后再氧化为乙醇 |
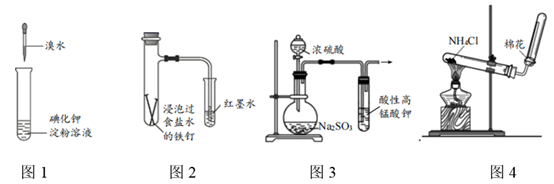
| ① | ② | ③ |
| | | |
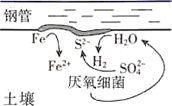
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法错误的是( )
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 配制FeCl3溶液 | 将FeCl3固体溶解于适量蒸馏水 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
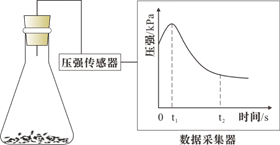
| D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
 C . 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中
C . 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 |
装置 |
编号 |
电极A |
溶液B |
操作及现象 |
|
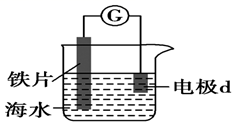
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是。
|
编号 |
溶液B |
操作及现象 |
|
Ⅲ |
经煮沸的pH=2的 H2SO4 |
溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
|
Ⅳ |
pH=2的H2SO4 |
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
|
Ⅴ |
pH=12的NaOH |
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是。
实验①:取A样品,加过量稀硝酸完全溶解后,再加入 溶液,有白色沉淀生成。
实验②:另取A样品4.29g,加入含 的稀硫酸溶液,恰好中和,生成两种盐的混合溶液。向所得混合溶液中加入适量的NaOH溶液,产生蓝色沉淀,经过滤、洗涤、灼烧得3.20g黑色固体。
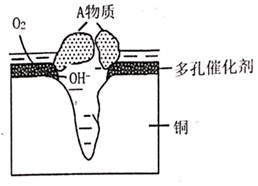
① 向极移动(填“正”或“负”)。
②若有 流过导线,则理论上负极质量减少g。
③若将稀硫酸换成浓硝酸,其负极的电极方程式为:。
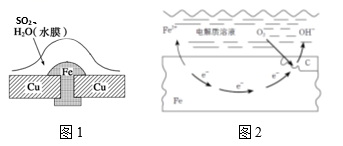
A.化学腐蚀 B.电化学腐蚀 C.析氢腐蚀 D.吸氧腐蚀
工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。

此过程中能量转化形式为转化为(填“化学能”或“电能”)
a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为 NaClO、ClO2 等含氯化合物可用于杀菌消毒
某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。

被腐蚀的是包裹的铁钉(填“锌片”或“铜片”)