



| 选项 | 化学反应方程式 | 已知条件 | 预测 |
| A | M(s)=X(g)+Y(s) | ΔH>0 | 它是非自发反应 |
| B | W(s)+xG(g)=2Q(g) | ΔH<0,自发反应 | x可能等于1、2、3 |
| C | 4X(g+5Y(g)=4W(g)+6G(g) | 能自发反应 | ΔH一定小于0 |
| D | 4M(s)+N(g)+2W(l)=4Q(s) | 常温下,自发进行 | ΔH>0 |
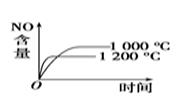 B .
B .  C .
C .  D .
D . 

第二阶段:将第一阶段反应后的气体分离出来,加热至230 ℃制得高纯镍。
下列判断正确的是( )
| 物质 | X | Y | Z | W |
| 初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |


已知:① C(s) + O2(g) = CO 2 (g) △H 1 = -393.5kJ·mol −1
② ΔH2=-571kJ mol−1
③H2O(l) = H2O(g) △H1 = +44kJ·mol−1
则碳与水蒸气反应 C(s) +2H2O(g) CO2(g)+2H2(g)的 ΔH = 。
CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H<0
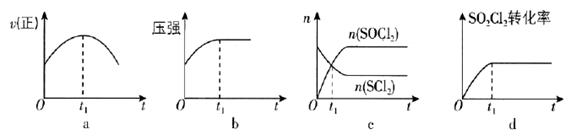
①在某 1L 恒温恒容密闭容器中充入 1mol CO2和 3molH2发生反应,测得 CO2(g)和 CH3OH (g)浓度随时间变化如下图 1 所示。则平衡时H2 (g)的转化率为,该温度下的平衡常数表达式为 K=。

②该反应在催化剂 Cu—ZnO—ZrO 2 表面进行,主反应历程如图 2 所示(催化剂表面吸附的物种用*标注),下列说法不正确的是。
A.该反应的原子利用率为 100%
B.催化剂可以降低反应活化能
C.反应②中,断裂和形成的共价键至少有 2种
D.使用催化剂可以提高反应的转化率
反应Ⅰ(主):CH3OH(g) + H2O(g) CO2(g) +3H2(g) △H 1 >0
反应Ⅱ(副):CO2(g) + H 2 (g) CO(g) + H2O(g) △H 2 >0
温度高于 300℃会同时发生反应Ⅲ:CH3OH(g) CO(g) + 2H 2 (g)
①反应 1能够自发进行的条件是。
②升温有利于提高 CH 3 OH 转化率,但也存在一个明显的缺点是。
③写出一条能提高 CH3OH 转化率而降低 CO生成率的措施。

已知该反应在反应过程中体系温度会升高,下列有关说法正确的是____。

①图中曲线表示的是(填“”“
”或“
”)的物质的量浓度随时间的变化,
时
的转化率为。
②内,用
表示该反应的速率为
。

部分阳离子以氢氧化物形式沉淀时溶液
|
沉淀物 |
|
|
|
|
|
完全沉淀的 |
3.7 |
9.6 |
9.2 |
5.2 |
回答下列问题:
Ⅰ.
Ⅱ.
回答下列问题:

①温度为 , 经
体系达到平衡,则
的平均反应速率为,该温度下反应Ⅰ的平衡常数
。
②随着温度的升高,的平衡转化率增加但甲醇的选择率降低,分析其原因。

已知:2H2(g)+O2(g) =2H2O(g);△H=-483.6kJ·mol-1 ①
2CO2(g)+4H2O(g) = 2CH3OH(g)+3O2(g);ΔH=+1352.8kJ·mol-1②
则用CO2与H2反应制备 CH3OH(g),同时生成水蒸气的热化学方程式为:
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH=。

试回答下列问题:
800℃时,0—5min内,以B表示的平均反应速率为。
a.容器中压强不变 b.混合气体中c(A)不变
c.2v正(B)=v逆(D) d.c(A)=c(C)
H2SO4(aq)=SO2(g)+H2O(l)+O2(g)ΔH1=+327 kJ·mol-1
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq)ΔH2=-151 kJ·mol-1
2HI(aq)=H2(g)+I2(s) ΔH3=+110 kJ·mol-1
①单位时间内生成n mol N2的同时生成2n mol NH3
②1个N≡N键断裂的同时,有6个N—H键形成
③1个N≡N键断裂的同时,有3个H—H键形成
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
为提高H2的转化率,实际生产中宜采取的措施是(填字母)。
A.及时移出氨B.适当增大压强C.循环利用和不断补充氮气
D.减小压强E.降低温度


反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| KⅠ | 2.0 | 0.27 | 0.012 |
a.充入CO,使体系总压强增大b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大d.使用高效催化剂

①i中现象为。
②ii中血红色褪去,结合离子反应和平衡移动解释原因。
③已知存在反应:2Fe3++SO +H2O=2Fe2++SO
+2H+ , 则证明iii中平衡逆向移动的准确实验现象描述是。
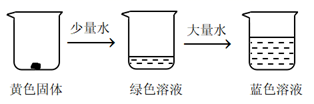
取适量CuCl2固体进行下面实验
判断正误(括号里填“√”或“×”):
①加少量水,溶液为绿色的原因是:溶液中同时存在较多的[Cu(H2O)4]2+和[CuCl4]2- , 黄色和蓝色的混合色为绿色。。
②加大量水,溶液变为蓝色的原因是:提高了c(H2O),平衡逆向移动,黄色的[CuCl4]2-转化为蓝色的[Cu(H2O)4]2+ , 所以溶液变为蓝色。。
③对绿色溶液进行加热,溶液变为黄绿色,因为反应吸热,升温平衡正向移动。。