B . 萝卜pH=4.6
B . 萝卜pH=4.6  C . 土豆pH=5.4
C . 土豆pH=5.4  D . 板栗pH=8.8
D . 板栗pH=8.8 



①碱的水溶液显碱性,但显碱性的不一定是碱的溶液; ② 用pH试纸测得食醋的pH为9.2; ③ 用洗洁精清洗油污是利用洗洁精的乳化功能; ④ 稀盐酸、稀硫酸化学性质相似是因为它们的溶液中所含的阳离子只有氢离子; ⑤ 打开浓盐酸瓶盖有白烟; ⑥ 浓硫酸不慎沾在皮肤上,要用大量水冲洗,再涂上硼酸溶液; ⑦ 生成盐和水的反应一定是中和反应



①用氢氧化钠溶液洗涤石油产品中的残余硫酸;②用碳酸氢钠治疗胃酸过多;
③用熟石灰改良酸性土壤;④用稀氨水(弱碱)涂抹在蚊子叮咬处(分泌出蚁酸)止痒
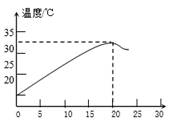
【提出问题】两者是否发生了化学反应?
【实验探究】将盛有上述实验混合液的试管标为①,如图甲.

小华:测得实验所用稀硫酸的pH<7,试管①中溶液pH>7.于是得出结论:.
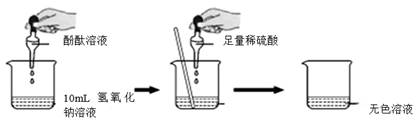
小敏:取两支试管,编号为②和③,分别加入稀硫酸和试管①中溶液各2mL,逐滴滴加Na2CO3溶液至过量,实验过程与现象如图乙,由此他得出了与小华一样的实验结论.
【反思评价】小军认为小敏在实验设计中存在不够严密的地方,请帮他指出:
【交流讨论】试管③中的溶液中有哪些溶质?同学们分析了两位同学的实验过程,一致认为没有H2SO4 , 其理由是.在此基础上,同学们提出了二种推理:
推理1:含有Na2SO4、Na2CO3和NaOH
推理2:含有Na2SO4、Na2CO3
正确的是推理(选填“1”或“2”)

|
实验方案 |
实验步骤 |
实验现象 |
实验结论 |
|
方案一 |
取样,滴入适量的氯化钡溶液 |
出现白色沉淀 |
稀硫酸过量 |
|
方案二 |
取样,滴入几滴紫色石蕊试液 |
溶液变红 |
稀硫酸过量 |
上述设计的实验方案中,正确的是(填“方案一”或“方案二”)。请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是,实验现象及对应结论是。
Ⅰ、写出该中和反应的化学方程式:。
Ⅱ、探究烧杯内溶液中溶质的成分。
(提出问题)该烧杯内溶液中的溶质是什么?
(猜 想)猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三:。
(查阅资料)氯化钙溶液呈中性。
(进行实验)
实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象:。结论:猜想一不正确。
实验步骤:取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量。
实验现象:。结论:猜想二不正确,猜想三正确。
根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?(填序号)
A.pH试纸 B.铜 C.紫色石蕊溶液 D.硝酸银溶液
杯中与NaOH溶液充分混合,测得混合后溶液的pH=8。
实验②:在烧杯中注入适量NaOH溶液,并滴加2滴酚酞试液,溶液呈红色;然后将一定量的稀盐酸注入烧杯中,发现红色褪去。


|
加入NaOH溶液的体积/mL |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
|
烧杯中溶液的pH |
1.1 |
1.2 |
1.4 |
1.6 |
2.0 |
7.0 |
11.0 |
12.2 |
(用化学式表示)
 B .
B .  C .
C .