 黄铁矿(主要成分FeS2)
C .
黄铁矿(主要成分FeS2)
C .  磁铁矿(主要成分Fe3O4)
D .
磁铁矿(主要成分Fe3O4)
D .  菱铁矿(主要成分FeCO3)
菱铁矿(主要成分FeCO3)

![]()





综合分析上述实验,回答下列问题:

| 反应前 | 反应后 | |
| A组 | 玻璃管和铁的氧化物的质量40.9g | 玻璃管和固体物质的质量36.1g |
| B组 | 烧杯和澄清石灰水的质量180g | 烧杯和烧杯中物质的质量186.2g |
试回答:

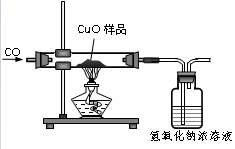

你认为他应该选用了(填“A”或“B”)组数据来计算赤铁矿石中氧化铁的质量分数;结合装置图回答他不选用另一组数据计算可能的原因。(写出一点即可)
|
反应前 |
反应后 |
|
|
A组 |
玻璃管和赤铁矿石样品的质量m1g |
玻璃管和固体物质的质量m2g |
|
B组 |
烧杯和澄清石灰水的质量m3g |
烧杯和烧杯中物质的质量m4g |

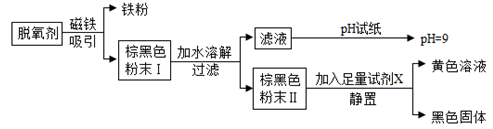
①取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液。



①当加入的硝酸钡溶液的质量为克时,沉淀刚好不再产生。
②计算废水中该酸的质量分数。
【提出问题】①氢氧化钠是否完全变质?②样品中氢氧化钠的质量分数是多少?
【查阅资料】①氢氧化钠与二氧化碳反应生成碳酸钠和水;
②向氢氧化钠和碳酸钠混合物中加入盐酸时,盐酸先与氢氧化钠反应,再与碳酸钠反应。
取少量该固体样品溶于水配成溶液,滴加足量的(填“Ca(OH)2溶液”或“CaCl2溶液”),观察到的现象,充分反应后过滤,向滤液中滴入少量的欲试液,观察到的现象,说明氢氧化的固体部分变质。
实验二:测定样品中氢氧化钠的质量分数
②计算过程:解:设样器中碳酸钠的质量为x
|
Na2CO3+2HCl=2NaCl+ |
CO2↑+H2O |
|
106 |
44 |
|
x |
4.4g |
x=10.6g
样品中氢氧化钠的质量分数= x100%=35.4%
【交流与反思】在交流时,老师问同学们“能否用上述实验所得的数据准确计算出样品中氢氧化钠的质量分数”,但小科分析后,认为久置的氢氧化钠固体会因吸水而潮解,所以方案一中测得样品中氢氧化钠的质量分数结果(填“偏大”或“偏小”)。


I.提出问题
问题1:铁为何称为黑色金属?
问题2:铁有多种氧化物,它们的性质有哪些差异?
问题3:钢铁厂在选矿时,如何测定铁矿石中的含铁量?
II.解决问题
a.在铁表面有黑色的铁的氧化物,早先以为这就是铁的颜色,所以叫黑色金属。
b.铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属。
你认为正确的说法是(填“a”或“b”)。
a.铁常见的氧化物有氧化铁(Fe2O3)、四氧化三铁(Fe3O4)和氧化亚铁(FeO)。
b.四氧化三铁是具有磁性的黑色晶体,可以近似地看作是氧化亚铁和氧化铁的化合物,它不溶于水,能与酸反应生成两种盐。
c.氧化亚铁是不溶于水的黑色粉末,能与酸反应,无磁性,也不能被磁铁吸引。
①请写出四氧化三铁与盐酸反应的化学方程式。
②有一包黑色粉末;可能是铁粉、Fe3O4粉末、FeO粉末中的一种,请你设计一种实验方案进行鉴别。



|
实验次数 |
1 |
2 |
3 |
4 |
5 |
6 |
|
取样品质量(g) |
35.0 |
35.0 |
35.0 |
35.0 |
35.0 |
35.0 |
|
加入稀硫酸质量(g) |
30.0 |
60.0 |
90.0 |
120.0 |
150.0 |
180.0 |
|
产生气体质量(g) |
0 |
0 |
0.1 |
0.3 |
0.5 |
0.6 |
|
项目 |
亚硝酸钠 |
氯化钠 |
|
溶解性 |
15℃时溶解度为81.5g |
15℃时溶解度为35.8g |
|
熔点 |
271℃ |
801℃ |
|
水溶液酸碱性 |
碱性 |
中性 |
|
跟稀盐酸作用 |
放出红棕色气体NO2 |
无现象 |
|
跟硝酸银溶液作用 |
生成白色沉淀 |
生成白色沉淀 |

甲  乙
乙 
⑴甲小组同学的实验如下:取少量滤液放入试管中,滴加过量的氯化钡溶液,再滴加稀硝酸,观察到有白色沉淀产生,反应的化学方程式为。过滤,再向滤液中滴加,又有白色沉淀产生,最终认为乙小组观点正确。
⑵乙小组同学认为甲组同学实验方法不合理,将氯化钡溶液改成硝酸钡溶液,其余方法步骤都相同。
⑶你认为甲、乙两小组的实验设计哪个合理?并说明理由。。

⑴确定要测定地块的采样点。
⑵将采集好的土样晾干、粉碎、称量,加蒸馏水充分搅拌后过滤,取滤液。
⑶对所取滤液进行以下实验:(实验过程中所加试剂均是足量的,得到的所有沉淀中的
阴离子都来自原土壤滤出液中)

⑷称量实验中得到的各种沉淀质量,计算得出盐碱地中上述三种盐的含量。
请回答下列问题: