 B . 锌锰干电池
B . 锌锰干电池 C . 锂离子电池
C . 锂离子电池 D . 硅太阳能电池
D . 硅太阳能电池

 B .
B .  C .
C .  D .
D . 





2022年北京冬奥会“飞扬”火炬使用的燃料 | 氧气 ( | ① ② |
2008年北京奥运会“祥云”火炬使用的燃料 | 丙烷 ( | ③ ④ ⑤ ⑥ |
①H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
③H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
则氢气的燃烧热为( )


①H2O(l)=H2(g)+ O2(g) ΔH=+285.8 kJ/mol
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
④C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ/mol
⑤C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
①H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
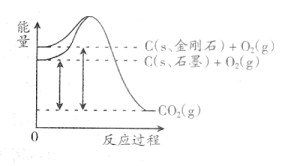
①石墨和金刚石相比,石墨的稳定性金刚石的稳定性。
②石墨中C-C键键能金刚石中C-C键键能。(均填“大于” “小于”或“等于”)。
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1= +206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2= -247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式。

①图中A点表示:;C点表示:;
E的大小对该反应的反应热(填“有”或“无”)影响。
②图中△H=kJ/mol。
①写出该反应的热化学方程式: ;
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH =kJ/mol。氢气的燃烧热为ΔH =kJ/mol。

反应物 | 起始温度 | 终了温度 | 中和热 |
13 | |||
13 |
①计算上述两组实验测出的中和热:提示。;
;
。
②两组实验结果差异的原因是。
③根据实验结果写出氢氧化钠溶液与盐酸反应的热化学方程式:。