 B .
B .  C .
C .  D .
D . 
 B . 熄灭酒精灯
B . 熄灭酒精灯 C . 过滤
C . 过滤 D . 测定溶液的pH
D . 测定溶液的pH 
 B . 稀释浓硫酸
B . 稀释浓硫酸 C . 检查气密性
C . 检查气密性 D . 测溶液pH
D . 测溶液pH
 量筒读数
B .
量筒读数
B . 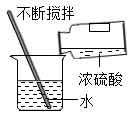 稀释浓硫酸
C .
稀释浓硫酸
C .  滴加液体
D .
滴加液体
D .  过滤
过滤
 B . 加热
B . 加热 C . 测pH
C . 测pH D . 稀释
D . 稀释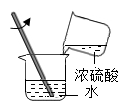
 溶解固体
B .
溶解固体
B .  蒸发溶液
C .
蒸发溶液
C .  过滤液体
D .
过滤液体
D .  稀释浓硫酸
稀释浓硫酸
选项 | 实验目的 | 实验方案 |
A | 稀释浓H2SO4 | 将水倒入浓H2SO4中并用玻璃棒不断搅拌 |
B | 鉴别NaOH和NH4NO3固体 | 取样,分别溶于水中,测量溶液温度的变化 |
C | 除去NaCl固体中少量的NH4Cl | 加入Ca(OH)2固体,研磨 |
D | 检验蜡烛中是否含有氧元素 | 在蜡烛的火焰上方罩一只干燥烧杯,观察现象 |
 B . 转移蒸发皿
B . 转移蒸发皿 C . 闻气味
C . 闻气味 D . 稀释浓硫酸
D . 稀释浓硫酸

①0~t1阶段,可能是铝表面有层氧化膜
②t1~t2阶段,可能是铝和稀盐酸反应放出热量
③t3时刻,可能是稀盐酸过量
④t3时刻,可能是稀盐酸不足
 B .
B .  C .
C .  D .
D . 
【实验目的】对选定实验中所需药品用量进行估算并验证估算用量足够。

①写出碳酸钙与稀盐酸反应的化学方程式:。
②取2g石灰石样品进行实验(样品中除碳酸钙外,其余成分既不与盐酸反应,也不溶解于水),请估算,至少需要溶质质量分数为7.3%的稀盐酸g。
方案一:
实验过程如下图所示:

①将石灰石研细的目的是。
②若图中试剂X为紫色石蕊试液,观察到的现象是,说明估算的稀盐酸用量足够。
③为达到与②相同的实验目的,试剂X还可以选择下列试剂中的(填字母序号)。
A FeCl3溶液 B Na2CO3溶液 C AgNO3溶液 D CuO
方案二:
④只用以下两种规定用量的药品:2g石灰石样品和估算用量的稀盐酸,设计实验进行验证,请简述实验方案。(实验仪器任选)
实验操作 | 实验现象 | 实验结论 |
估算的稀盐酸用量足够 |
【拓展延伸】药品用量的估算方法及估算结果受很多因素的影响,实验中需要结合具体的情况合理运用。

①用图中仪器完成实验,还缺少的玻璃仪器是(填名称),玻璃棒在配制实验中的作用是。
②配制该溶液需要g水。用量筒量取水时,俯视读数会导致所配溶液的溶质质量分数10%。(填“大于”或“小于”)
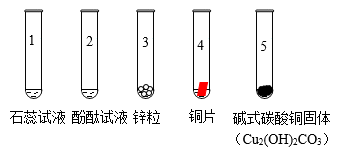
①中溶液变为红色(填“试管1”或“试管2”)。
②试管3中产生气泡,试管4中无明显现象,由此推断金属活动性Cu比Zn(填“强”或“弱”)。
③试管5中生成一种盐和两种氧化物,该反应的化学方程式为。
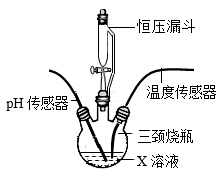
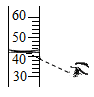
①甲同学用pH传感器测得三颈烧瓶内溶液pH的变化如题图,判断溶液X是,实验进行到60s时溶液中的溶质为(填化学式)。

②乙同学用温度传感器测得三颈烧瓶内温度变化如图(实验过程中热量散失忽略不计),据此可得出反应过程中能量的结论(填“吸收”或“释放”)。
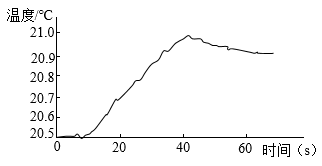
③丙同学提出,通过监测三颈烧瓶内压强变化,也可以推导出乙同学的实验结论,其理由是。

①维生素C(C6H8O6)具有增强机体抵抗力,预防和治疗坏血病等作用。某品牌维生素C泡腾片主要成分如图。
②柠檬酸为食用酸类,由碳、氢、氧三种元素组成,可增强体内正常代谢,适当剂量对人体无害。柠檬酸易溶于水,20℃时,其2%水溶液的pH为2.1。
③碳酸氢钠在医疗上是治疗胃酸过多的药剂之一,写出该反应的化学方程式。
【猜想与假设】
同学甲认为产生的气体中不可能含有CO和H2 , 因为从药品安全角度考虑,H2易燃易爆,CO。
同学乙认为产生的气体也不可能含有N2 , 因为。
同学丙认为该气体可能含有O2、CO2中的一种或两种。
实验编号 | 实验操作 | 实验现象 | 实验结论 |
I | 将一片维生素C泡腾片放入装有水的试管中 | 有大量气泡产生 |
|
II | 将带火星的木条伸入试管 | 带火星的木条没有复燃 | 该气体中不含O2 |
III | 将气体通入澄清石灰水中 | 澄清石灰水变浑浊 | 该气体中含有 |
同学丁认为由实验II不能确定该气体中不含O2 , 理由是。同学们经过讨论,设计了更为严谨的实验,最终证明了该气体中不含氧气。
维生素C泡腾片的保存注意事项是。

实验完毕后,小明误将A试管中的物质倒入B试管中,充分振荡后,观察到混合后溶液为无色。小明对该无色溶液的成分产生兴趣并展开探究(温馨提示:本题中番号①~⑤为答题卡上的序号)。
【查阅资料】NaCl溶液、CaCl2溶液显中性。
【猜想与假设】猜想-:NaCl、CaCl2;
猜想二:NaCl、CaCl2、HCl;
猜想三:NaCl、CaCl2、Ca(OH)2;
经分析猜想三错误,其理由是。
|
实验操作 |
实验现象 |
解释与结论 |
|
取少量混合后的无色溶液于试管中,加入锌粒 |
|
解释实验现象:(用化学方程式表示) 得出实验结论:猜想二正确 |
Ⅰ.有同学提议将上表操作中的锌粒换成另一种药品或用品:(除金属外),也可得出猜想二正确的实验结论。
Ⅱ.小明误倒后,如果观察到试管底部有白色沉淀,上层清液为红色,则上层清液中一定有的阴离子是(填写离子符号)。