物质 | 厕所清洁剂 | 橘子 | 西瓜 | 鸡蛋清 | 牙膏 | 炉具清洁剂 |
pH | 1~2 | 3~4 | 6-7 | 7-8 | 8-9 | 12~13 |
选项 | 劳动项目 | 化学原理 |
A | 学农活动:撒熟石灰改良酸性土壤 | 熟石灰具有碱性 |
B | 学工活动:炼铁高炉将铁矿石炼成铁 | 铁矿石受热易分解 |
C | 家务劳动:用洗涤剂清洗餐具油污 | 洗涤剂的乳化功能 |
D | 社区活动:回收废弃塑料,减少“白色污染” | 塑料在自然环境中难降解 |


【活动目的】鉴别空气与氧气
【操作及结论】
实验操作 | 实验现象 | 实验结论 |
向两种气体中分别伸入带火星的木条 | 木条 | 该气体为氧气 |
木条无明显变化 | 该气体为空气 |
【活动目的】鉴别氢氧化钠与氯化钠
【操作与结论】分别取少量固体于两个表面皿上,在空气中放置一会儿,观察到其中一种固体表面潮湿并逐渐溶解,该固体为,而表面无明显变化的为另一种固体。
【活动目的】鉴别稀硫酸与碳酸钠溶液
【查阅资料】碳酸钠溶液呈碱性
【实验操作】将两种溶液编号为甲溶液、乙溶液,并分别取样于两支试管中,分别滴加稀盐酸。
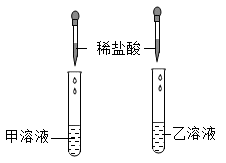
【实验现象】甲溶液中无明显现象,乙溶液中有气泡产生。
【实验结论】甲溶液为,乙溶液为另一种溶液。
乙溶液中产生气泡的化学方程式为。
A.酚酞溶液 B.氧化铜 C.铜
活动感悟:在进行物质鉴别时,首先要分析物质的组成、性质等,然后选择合适的方法进行实验,实验过程中必须产生,最后才能达到物质鉴别的目的。
a.酸性 b.吸水性 c.氧化性 d.脱水性
①如图是氢氧化钠溶液与盐酸反应的示意图,用实际参加反应的离子符号来表示该反应的式子可写为。

②若向稀氢氧化钠溶液中滴入几滴酚酞溶液,然后再向其中滴入稀盐酸至过量,则观察到溶液颜色的变化是。
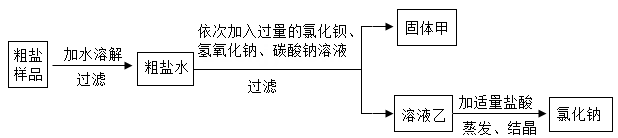
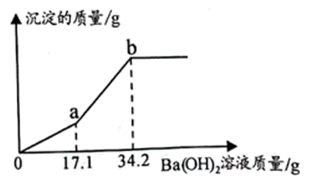
①溶解、过滤、蒸发的操作中都需要用到的一种玻璃仪器为(填“烧杯”“漏斗”或“玻璃棒”)。
②固体甲中所含有的难溶性物质为BaSO4、、CaCO3和BaCO3。
③请设计实验验证溶液乙中所含有的杂质。(简要叙述实验步骤及现象)


A.NaNO3 B.CuSO4 C.NH4NO3 D.KNO3

在实验1中,用滴管缓慢滴入稀盐酸,并不断搅拌。观察到烧杯内溶液由红色变为无色,该现象能证明氢氧化钠与盐酸反应,依据是。用玻璃棒不断搅拌的作用是。反应后溶液中一定含有的粒子是(不考虑酚酞)。
在实验2中,将稀盐酸全部注入试管中,立即固定活塞。观察到氢氧化钠固体全部消失,U形管的液面左低右高,部分同学由此认为氧氧化钠和盐酸发生了反应。但有的同学不赞同,理由是(装置气密性良好,稀盐酸挥发忽略不计):他认为仍利用此装置,再补充一个实验才能达成实验2目的,实验需要的试剂及用量为。
小可认为该溶液中溶质是NaOH:
小琳认为该溶液中溶质是Na2CO3:
小明却认为该溶液中溶质是(填化学式)。
【进行实验】
实验 | 实验操作 | 实验现象 |
① | 小可取适量该溶液,滴入几滴无色酚酞溶液 | 溶液变红色 |
② | 小琳取适量该溶液,滴入几滴氯化钡溶液 | 产生白色沉淀 |
③ | 小明取适量该溶液,滴入过量氯化钡溶液 | 产生白色沉淀 |
④ | 小明取适量实验③所得的上层清液,滴入几滴无色酚酞溶液 | 溶液变红色 |
【实验结论】
①根据实验①和②可以得出结论:该溶液中一定含有的溶质是(填化学式)。同学的猜想一定是错误的。原因是。
②根据实验③和④。你认为小明同学的猜想(填“正确”或“不正确”)。
①氢氧化钠溶液变质的原因是(用化学方程式表示)。
②实验室为了防止氢氧化钠溶液变质,正确的措施是(写出一条即可)。
小吴按照说明书将适量茶垢清洁剂放入有茶垢的杯子中,加入热水浸没茶垢,立即产生大量气泡,一段时间后冲洗茶杯,茶杯光亮如新。
【查阅资料】茶垢清洁剂的主要成分为过碳酸钠(Na2CO4)。
【猜想与假设】同学们对该气体的成分提出了三种猜想。
猜想1:只有O2;猜想2:;猜想3:既有O2又有CO2。
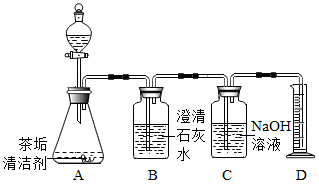
操作 | 现象 | 结论 |
检查气密性后,向A中加入热水,将生成的气体依次通过B、C,向D中插入带火星的木条。 | 观察到B中,D中木条复燃。 | 猜想1正确。 |
【猜想与假设】同学们查阅资料后,作出三种猜想。
猜想1:只有Na2CO3;
猜想2:只有NaOH;
猜想3:既有Na2CO3又有NaOH。
【实验验证】小施从下列试剂中选择合适的试剂完成探究:稀盐酸、饱和Ca(OH)2溶液、CaCl2溶液、酚酞溶液、Ba(OH)2溶液。
操作 | 现象 | 结论 |
步骤1:取少量溶液E,滴加。 | 有气泡产生 | 溶液中一定有 Na2CO3 , 猜想2不正确。 |
步骤2:另取少量溶液E,滴加CaCl2溶液至不再产生沉淀为止,向上层清液中加入。 | 无明显现象 | 溶液中无NaOH,猜想3不正确,猜想1正确。 |
①根据过碳酸钠的性质,保存茶垢清洁剂应注意。
②过氧化钠(Na2O2)常用作供氧剂,其与水反应的历程与过碳酸钠类似,即先与水反应生成过氧化氢和一种碱,之后过氧化氢迅速分解。请写出过氧化钠与水反应的总反应方程式。

【资料信息】
吸湿区内黑色颗粒是活性炭,白色颗粒是初中化学一种常见物质。使用一段时间后,集水区内有大量液体和少量固体,且气温越低固体越多。
【作出猜想】猜想Ⅰ:氧化钙:猜想Ⅱ:氢氧化钠:猜想Ⅲ:氯化钙。
猜想依据:氧化钙能与水反应,氢氧化钠和氯化钙在空气中容易水分。

【解释与结论】小组同学依据实验得出结论:白色颗粒是氯化钙。
步骤②的现象是。
步骤③的化学方程式为(写一个)。
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
溶解度/g |
59.5 |
65.0 |
74.5 |
100 |
116 |
①集水区内“气温越低固体越多”的原因是。
②从绿色化学的角度考虑,除湿盒使用后,对集水区内物质的处理建议是。
【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】工业制取NaOH的反应原理是: , 然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
【提出猜想】杂质为碳酸钠和氯化钠。
【实验探究】①甲同学取样溶于水,向溶液中滴加酚酞溶液,观察到液体变红色,认为杂质中含有碳酸钠。乙同学认为甲同学的实验不足以证明杂质中含有碳酸钠,理由是。
②乙同学重新设计实验如下:
实验操作 | 实验现象 | 实验结论 |
步骤a:取样溶于水,向溶液中滴加过量稀硝酸 | 杂质中含有碳酸钠 | |
步骤b:向a所得溶液中继续滴加硝酸银溶液 | 有白色沉淀产生 | 杂质中含有 |

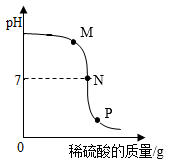
Ⅰ、向滴加有酚酞的NaOH溶液中慢慢滴入稀盐酸(如图1所示),边滴加边振荡,测得试管①中最终溶液的pH=2。
Ⅱ、分别称取0.5g氢氧化钙粉末置于两支试管中,各滴加2mL水,振荡;再向试管②中加入2mL水、试管③中加入2mL稀盐酸(如图2所示)。振荡并观察现象。
Ⅲ、向盛有氢氧化钠溶液的试管④中加入少量硫酸铜溶液,振荡。静置后测得上层清液的pH=12,继续向其中滴加几滴稀盐酸(如图3所示),试管⑤中无明显现象。
实验Ⅰ中,能证明盐酸和氢氧化钠发生了化学反应的实验现象是。试管①最终溶液中含有的溶质有(酚酞除外)。
【实验探究二】取试管①反应后的溶液逐滴滴入试管⑤中,直至过量,边加边振荡。
实验探究二中依次观察到的现象有。
【结论】盐酸能与Cu(OH)2发生反应。
【交流反思】最终试管⑤溶液中大量存在的离子有。

【反思交流】
使废液变成红色的物质是什么?
【做出猜想】
猜想一:只有Na2CO3
猜想二:只有NaOH
猜想三:NaOH和Ca(OH)2
猜想四:NaOH和Na2CO3
你认为以上猜想中,不合理的是猜想。
CaCl2溶液呈中性。
【验证猜想】
静置一段时间后,取少量废液缸中的上层红色清液于试管中,加入过量CaCl2溶液,有白色沉淀生成。静置后,发现试管中的上层清液仍为红色,由此证明了猜想成立。
【实验探究】将氢氧化钾溶液与稀硫酸混合,观察不到明显现象,为证明氢氧化钾溶液与稀硫酸发生了反应,三位同学进行了以下实验。

甲同学在实验过程中测得pH变化如图1所示,则该同学是将(填字母序号)。
a.氢氧化钾溶液滴入稀硫酸中 b.稀硫酸滴入氢氧化钾溶液中
乙同学在实验过程中测得反应混合溶液的温度变化如图2所示,说明稀硫酸与氢氧化钾溶液发生的反应是(填“放热”或“吸热”)反应。图2中B点表示的含义是。
丙同学通过图3所示实验,他观察到溶液由红色变成无色,也证明氢氧化钾溶液与稀硫酸发生了化学反应,反应的化学方程式为。
【猜想与假设】
猜想一:只有K2SO4;猜想二:有K2SO4和H2SO4;猜想三:有K2SO4和KOH
【进行实验】为了验证猜想,学习小组选用Fe2O3粉末、BaCl2溶液,进行如下探究:
实验方案 | 实验操作 | 实验现象 | 实验结论 |
方案一 | 取少量反应后的溶液于试管中,加入Fe2O3粉末 | 溶液中有H2SO4猜想二正确 | |
方案二 | 取少量反应后的溶液于试管中,滴加BaCl2溶液 | ②产生白色沉淀 | 溶液中有H2SO4 , 猜想二正确 |
【实验结论】通过探究,同学们一致确定猜想二是正确的。
丁同学针对上述方案提出疑问,认为方案二是不合理的,理由是。

①氢氧化钠固体应放在玻璃器皿中称量的原因是;
②用量筒量水时仰视读数,会导致测定废液中硫酸的质量分数结果(选填“偏大”、“偏小”或“不变”)。