①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨 ⑤熔融的NaOH ⑥稀硫酸 ⑦乙酸
| 选项 | A | B | C | D |
| 强电解质 | Fe | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
| 非电解质 | 蔗糖 | BaSO4 | 酒精 | Cl2 |
①0.05mol/LH2SO3溶液的c(H+)=10-3mol/L
②相同条件下,H2SO3的导电能力比H2SO4弱
③H2SO3不稳定,易分解
④H2SO3能与碳酸钠反应制CO2
⑤H2SO3能和水以任意比例互溶
⑥1molH2SO3能够消耗2molNaOH
①将硫酸钡放入水中不能导电,但硫酸钡是电解质
②氨溶于水得到的溶液氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物能导电
⑤强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强

1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
酸 | 碳酸 | 次溴酸(HBrO) |
Ka(25℃) | K1=4.30×10-7 K2=5.61×10-11 | 2.4×10-9 |
①HBrO+Na2CO3=NaBrO+NaHCO3 ②2HBrO+Na2CO3=2NaBrO+H2O+CO2↑ ③NaBrO+CO2+H2O=NaHCO3+HBrO ④HBrO+NaHCO3=NaBrO+H2O+CO2↑
| 弱酸 | HClO | H2CO3 |
| 电离常数(25℃) | K=3.2×10-8 | K1=4.3×10-7 K2=4.7×10-11 |
弱酸 | HF | HClO | H2CO3 |
电离平衡常数(25℃) | 6.3×10-4 | 4.0×10-8 | Ka1=4.5×10-7 Ka2=4.7×10-11 |
下列离子方程式书写正确的是( )
a.加入少量0.10mol•L﹣1的稀盐酸
b.加热
c.加水稀释至0.010mol•L﹣1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10mol•L﹣1的NaOH溶液.
请回答下列问题.(填相应序号)
上述物质能导电的是;属于非电解质的是;属于强电解质的是;写出⑧的电离方程式:.
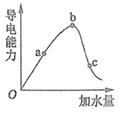
①a、b、c三点对应的溶液中,醋酸电离程度最大的是; 最小的是.
②在稀释过程中随着醋酸浓度的降低,下列始终保持增大趋势的量是
A. B.
C.
分子数 D.
①向 溶液中通入少量
:
②向 溶液中滴入少量新制氯水:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
a.CO32- b.ClO- c.CH3COO- d.HCO3-
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
②乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a , 然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b , 若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是。
③丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入少量NH4Cl晶体,颜色变(填“深”或“浅”)。你认为证明氨水是弱碱的原因是。
④请你根据所提供的试剂,再提出一个合理简便的方案证明NH3·H2O是弱电解质:。