
下列说法错误的是( )


有关说法错误的是( )
|
选项 |
实验 |
现象 |
结论 |
|
A |
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 |
有气体生成,溶液呈血红色 |
稀硝酸将Fe氧化为Fe3+ |
|
B |
将铜粉加入1.0mol·L-1 Fe2(SO4)3溶液中 |
溶液变蓝、有黑色固体出现 |
金属铁比铜活泼 |
|
C |
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 |
熔化后的液态铝滴落下来 |
金属铝的熔点较低 |
|
D |
将0.1mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol·L-1 CuSO4溶液 |
先有白色沉淀生成,后变为浅蓝色沉淀 |
Cu(OH)2的溶度积比 Mg(OH)2的小 |
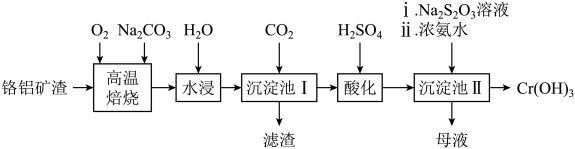
已知:①“高温焙烧”可以使矿渣转化为可溶性盐。
②酸性条件下,能稳定存在。

①相同条件下,溶解度:(填“>”或“<”)
。
②“煅烧”时称取白云石,高温加热到质量不再变化,收集到的
为
(标准状况下),若工艺中不考虑
损失,则
和
的质量分别为、。

请用离子方程式表示以上工艺流程中第①步反应:。

写出下列物质的化学式:
B, C, E, F。
C→E;
F→C。

回答下列问题:
①HCl气体的发生装置应选择装置(填字母,下同),用水吸收多余的HCl气体时,应该选择装置,其原因是。

②写出制备HCl反应的化学方程式:,该反应利用了浓H2SO4的性质是(填“脱水性”“氧化性”或“难挥发性”)

回答下列问题:

在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□═□Fe(OH)3↓+□Cl-+□_
②检验滤液B中是否还含有铁元素的方法为:
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、(填操作名称)、过滤、洗涤。
明矾曾经是净水明星,用离子方程式表示其净水原理。
I.假设为: 固体产物为MgO;II.假设为:;III.假设为: 。

①实验装置连接的顺序为(填字母序号);
②装置B中盛装的试剂可以是 (填字母)
a.浓硫酸 b.碱石灰 c.无水CaCl2 d.五氧化二磷
③确定产物中有N2生成的实验现象为。
(2−x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1−x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1−x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。