箭环蝶成虫常聚集在植物发酵腐烂处取食,它们喜欢吃什么呢?研究人员取四条干燥有吸 水性的相同绳子,分别浸泡在清水、0.5%白酒(溶质为酒精)、0.5%蔗糖水、0.5%食盐水中 相同时间。取出,相隔相同距离悬挂在环境相同的竹林之间。统计2小时内每条绳子上 箭环蝶停留数,数据如下表。
|
箭环蝶停留数(只) |
清水 |
0.5%白酒 |
0.5%蔗糖水 |
0.5%食盐水 |
|
绳子上段 |
0 |
0 |
0 |
0 |
|
绳子中段 |
0 |
3 |
1 |
1 |
|
绳子底端 |
0 |
35 |
2 |
0 |


|
烧杯1 |
烧杯2 |
烧杯3 |
|
|
样品溶液(克) |
10 |
20 |
30 |
|
氯化钙溶液(克) |
30 |
30 |
30 |
|
沉淀质量(克) |
2 |
4 |
5 |
(Na2CO3+CaCl2=CaCO3↓+2NaCl)

材料一:可燃冰的主要成分是甲烷的水合物,海底古生物尸体的沉积物被细菌分解后会产生甲烷。1m3可燃冰可转化生成约160m3常温常压下的甲烷气体和0.8m3的水,常温常压下,1m3甲烷气体完全燃烧可以释放3.6×107J的热量。
材料二:实验室常用加热无水醋酸钠和碱石灰两种固体的混合物的方法来制取甲烷。
材料三:甲烷气体也会产生温室效应。下表为两种气体的温室效应指数及对地球温室效应的贡献百分比。
|
温室效应气体 |
温室效应指数 |
对温室效应贡献百分比 |
|
二氧化碳 |
1 |
55% |
|
甲烷 |
21 |
15% |
|
备注:温室效应指数是指以二氧化碳为基准,测定一定大气压每单位我就的气体所吸收的热量。 |
||
根据以上材料,回答下列问题:


部分实验步骤如下:
Ⅰ.将质量为10g的样品装入装置B的玻璃管中,按图连接好装置,先打开弹簧夹通入空气,一段时间后,关闭弹簧夹,将装置C、D称重,然后给样品加热;
Ⅱ.待样品完全反应,再打开弹簧夹通入空气,再熄灭酒精喷灯,直到玻璃管冷却;
Ⅲ.实验完毕,再次称量装置C、D的质量,发现分别增加了2.0g和2.2g;
Ⅳ.根据实验所测数据计算该样品中碳酸钙、氢氧化镁和水的质量分数。
请回答下列问题:
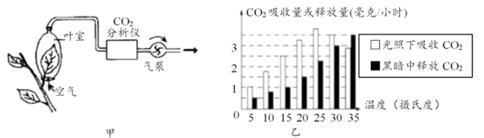
|
记录时间(分) |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
A种植物叶片 |
150 |
113 |
83 |
58 |
50 |
48 |
48 |
48 |
48 |
48 |
|
B种植物叶片 |
150 |
110 |
75 |
50 |
35 |
18 |
8 |
8 |
8 |
8 |

①打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
②准确称得6g纯碱样品放入容器b中;
③打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g;
④按图连接装置,并检查气密性;
⑤准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;。试回答:


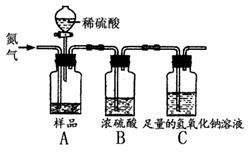
A.样品中滴加硫酸过量
B.A瓶内部分水蒸气随二氧化碳逸出
C.反应结束后,A瓶内有二氧化碳残留
D.反应速度过快,大量气泡从氢氧化钠溶液中出来
方案一:按如图甲实验方案,取石灰石样品和足量的稀盐酸进行实验,通过测量反应前后装置总质量的变化来计算石灰石样品中碳酸钙的含量。
方案二:利用气密性良好的图乙装置进行实验:①称取石灰石样品8克,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入氮气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置C总质量不再增加时停止鼓入氮气。实验过程中测得装置C增加的质量随时间变化图像如图丙。



|
反应时间/min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
锥形瓶及所盛物质总质量/g |
230 |
229.3 |
228.7 |
228.5 |
228.4 |
228.4 |
228.4 |


根据上述实验,推测要使莴苣种子的萌发率接近100%,需要的光照情况是。
【实验材料】同等质量的清炒芹菜,清炒菠菜,小白菜炒肉。
【实验过程】将试样切碎混匀,每个菜都分成均等的2组。一组样本放进实验室冰箱,在4℃下冷藏;另一组样本在常温下放置(20℃)。保存20小时后,按照测定亚硝酸盐的国家标准分别对其进行测定。
【实验结果】3种菜肴放置20小时后,测定出的亚硝酸盐含量(单位:克)如图所示,都远未超过国家标准。

请根据资料回答下列问题:
请回答下列问题:

| 水的流量Q 水的冲击力F/N 高度H/m | 0.5Q0 | Q0 | 1.5Q0 |
| 0.05 | 0.5 | 1 | 1.5 |
| 0.20 | 1 | 2 | 3 |
| 0.45 | 1.5 | 3 | 4.5 |



①写出你选用的实验仪器:;
②简述操作方法、实验现象和结论:
| 时间(分钟) | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| 产生气体质量(克) | 0 | 1.80 | 3.00 | 3.60 | 3.96 | 3.96 | 3.96 |
材料一:可燃冰的主要成分是甲烷的水合物,海底古生物尸体的沉积物被细菌分解后产生甲烷。1m3可燃冰可转化成约160m3常温常压下的甲烷气体和0.8m3的水,常温常压下,1m3甲烷气体完全燃烧可以释放3.6×107J的热量。
材料二:实验室常用加热无水醋酸钠和碱石灰固体混合物来制取甲烷。
材料三:甲烷气体也会产生温室效应。下表为两种气体的温室效应指数及对地球温室效应的贡献百分比.
|
温室效应气体 |
温室效应指数 |
对地球温室效应贡献百分比 |
|
二氧化碳 |
1 |
55% |
|
甲烷 |
21 |
15% |
|
备注:温室效应指数是指以二氧化碳为基准,测定一定大气压下毎单位体积的气体所吸收的热量. |
||
根据以上材料,回答下列问题:

A.雪碧 B.啤酒 C.白醋
|
实验一 |
实验二 |
实验三 |
实验四 |
|
|
食用碱的质量/g |
10 |
10 |
10 |
10 |
|
加入CaCl2溶液的质量/g |
20 |
40 |
60 |
80 |
|
生成沉淀的质量/g |
3 |
m |
8 |
8 |
请分析表中数据回答并计算:
①采用如图所示的测定方案,加入的氯化钙溶液必须过量,其目的是 。

②该纯碱样品中碳酸钠的质量分数是多少?
③通过已知数据还能求出的量有(填字母编号,符合题意的选项都选)。
A.纯碱样品中氯化钠的质量B.反应中生成氯化钠的质量
C.加入氯化钙溶液中所含溶质的质量D.反应后所得溶液中溶质质量分数
还有同学用图所示装置测定CO2质量(碱石灰的主要成分是氧化钙和氢氧化钠的混合物),再通过方程式计算得出样品中碳酸钠的质量分数。但有同学认为用该装置测量会使实验结果有很大误差,请写出理由。

①省去装置甲和丁②装置乙不再产生气泡时,立即停止抽气 ③在乙和丙之间再加一个装有浓硫酸的洗气瓶④将丙中的NaOH溶液换成Ca(OH)2溶液⑤滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2


|
塑料袋 |
水的质量m/kg |
初温t0/℃ |
温度t1/℃ |
温度t2/℃ |
温度t3/℃ |
… |
|
黑色 |
1.0 |
15.0 |
22.3 |
27.8 |
31.5 |
… |
|
白色透明 |
1.0 |
15.0 |
16.5 |
17.8 |
19.0 |
… |
|
次数 |
1 |
2 |
3 |
4 |
5 |
6 |
|
加入锌的质量(g) |
2 |
4 |
6 |
8 |
10 |
12 |
|
稀硫酸的质量(g) |
60 |
60 |
60 |
60 |
60 |
60 |
|
生成的硫酸锌的质量(g) |
5 |
15 |
16.1 |
16.1 |
据有关研究,汽车所用燃料的60%是消耗于汽车自身质量,汽车自身质量每降低100kg,每百公里油耗可减少0.6L左右,每节约1L燃料可减少CO2排放2.5kg。该款型号汽车原来使用的是质量高达1027kg的钢质外壳(钢的密度为7.9g/cm3),若替换成等体积的镁合金
材质,质量可减小780kg。请计算:

|
实验序号 |
1 |
2 |
3 |
|
碳酸氢钠片样品质量/克 |
3.0 |
3.0 |
3.0 |
|
反应前总质量/克 |
193.8 |
194.6 |
193.6 |
|
反应后总质量/克 |
192.6 |
193.6 |
192.5 |
|
二氧化碳质量/克 |
请计算药片中碳酸氢钠的质量分数。


