实验1 将镁条放入滴有酚酞的蒸馏水中,无明显现象,加热溶液,镁条表面产生气泡,溶液逐渐变红
实验2 将镁条放入滴有酚酞的1
溶液中,产生气泡,溶液逐渐变红
实验3 将镁条放入滴有酚酞的1溶液(pH≈7),产生气泡,溶液逐渐变红
实验4 将镁条放入滴有酚酞的1NaCl溶液中,产生气泡,溶液逐渐变红
下列基于相应实验现象得出的结论错误的是
选项 | 物质性质 | 物质用途 |
A | 小苏打能与碱反应 | 可用作抗酸药 |
B |
| 可用作耐高温材料 |
C |
| 可用作呼吸面具供氧剂 |
D | 漂白粉具有强氧化性 | 可用于生活用水的消毒 |


已知:SiO2在“碱溶”时转化为铝硅酸钠沉淀。下列说法正确的是( )
| 目的 | 方案设计 | 现象和结论 | |
| A | 比较金属铝和氧化铝熔点的高低 | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 铝箔熔化但不滴落,说明金属铝的熔点比氧化铝低 |
| B | 检验某牙膏中是否存在甘油 | 取少量该牙膏样品于试管中,加适量蒸馏水,搅拌、静置,取上层清液,加入适量新制氢氧化铜,观察现象 | 若产生绛蓝色沉淀,则该牙膏中含甘油 |
| C | 检验乙醇的消去产物中有乙烯 | 将产生的气体通入酸性高锰酸钾溶液 | 若高锰酸钾褪色,则证明产物中有乙烯 |
| D | 检验Cu2O中是否含有Cu | 取样,加入稀硝酸,观察现象 | 若有气泡产生,则说明样品中有Cu |
(2−x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1−x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1−x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。

已知:①相关金属离子形成氢氧化物沉淀的
范围如下:
金属离子 | ||||||
开始沉淀的 | 6.3 | 1.8 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 | 8.3 | 3.2 | 4.7 | 10.9 | 8.2 | 8.9 |
②当离子完全沉淀时,。
回答下列问题:

①氧铬酸钙的化学式为。
②1个钙原子与个氧原子最近且等距离。
③该晶体密度为(列出计算式即可。已知
和O的最近距离为
,
代表阿伏加德罗常数)

已知:碳酸锂的溶解度为(g/L)
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |


TiF4的熔点比TiCl4熔点高很多的原因是。
在上述操作中,需要用到图中的实验仪器有(填选项)。


①把盐酸换成不具有挥发性的硫酸
②在A~B之间增添盛有浓硫酸的干燥装置
③滴加盐酸的速率不宜过快
④在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置

已知:①Ksp[Fe(OH)3]=10-39;②Li2CO3的溶解度:0℃为1.54g,100为0.72g。
①若试剂1为强碱,则试剂1与B反应的离子方程式为。
②若试剂1和试剂2为同种物质,则C溶液显(填“酸性”、“碱性”或“中性”)。
①写出单质Y与稀硝酸反应生成E的离子方程式。
②可用于检验D的阳离子的试剂是。
注:c(C)T=c(CO )+c(HCO
)+c(H2CO3)

①a点(pH≈8.2)时溶液中析出的沉淀主要为(填化学式)。
②b点溶液中Ni2+是否沉淀完全(填“是”或“否”)[溶液中总镍浓度c(Ni)T≤10-5mol·L-1时,Ni2+沉淀完全] 。

试回答下列问题:
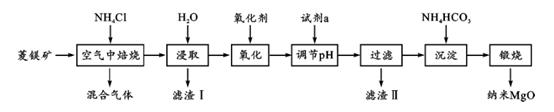
已知在该条件下金属离子开始沉淀和完全沉淀的pH 如下:
|
金属离子 |
Fe2+ |
Fe3+ |
Mg2+ |
|
开始沉淀pH |
6.3 |
1.5 |
8.9 |
|
完全沉淀pH |
8.1 |
2.8 |
10.9 |
上述流程中“氧化”是否可省掉及理由是 .
步骤1:CuSO4标准液的配制与标定。取一定量胆矾溶于水,加入适量稀H2SO4 , 转移到1 L容量瓶中定容。准确量取25.00 mL所配溶液置于250 mL锥形瓶中,用0.005 0 mol·L-1EDTA标准液滴定至终点。重复3次实验,平均消耗EDTA标准液10.00 mL 。
步骤2:样品分析。取10.00 mL矿业废水置于250 mL锥形瓶中,加入一定体积柠檬酸,煮沸;再加入0.005 0 mol·L-1的EDTA标准液20.00 mL,调节溶液pH至4.0,加热;冷却后用CuSO4标准液滴定至终点,消耗CuSO4标准液30.00 mL。(已知:Cu2+、Al3+与EDTA反应的化学计量比均为1∶1)
步骤1中,重复3次实验的目的是。
② Fe3+也可与EDTA反应,步骤2中加入的柠檬酸是作为掩蔽剂,消除Fe3+的干扰。若该矿业废水样品中含有Fe3+ , 而上述实验中未加入柠檬酸,则测定的Al3+含量将(填“偏大”“偏小”或“无影响”)。
③计算该矿业废水中Al3+的含量(用mg·L-1表示)(写出计算过程)。