A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |


已知:+4价钒在弱酸性环境中具有还原性。下列说法正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 向某无色溶液中加入稀盐酸 | 生成的无色气体能使品红褪色 | 该无色溶液中存在 |
B | 向FeBr3溶液中加入足量H2O2 | 生成大量气泡 | FeBr3作氧化剂且氧化性: Fe3+>H2O2 |
C | 一定温度下,向某容器中充入HI气体,一段时间后压缩容器体积为原来的一半 | 气体颜色变深 | 气体压强增大使平衡正向移动 |
D | 将溴乙烷制备乙烯生成的气体依次通过足量蒸馏水、酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 乙烯能被酸性高锰酸钾氧化 |

难溶电解质 | PbSO4 | PbCO3 | BaSO4 | BaCO3 |
Ksp | 2.5×10-8 | 7.4×10-14 | 1.1×10-10 | 2.6×10-9 |
下列说法错误的是

实验操作 | 实验结论 | |
A | 向NaHA溶液中滴加紫色石蕊溶液,溶液变为蓝色 | Kw>Ka1(H2A)·Ka2(H2A) |
B | 常温下将铝片投入浓硝酸中,无明显现象 | 铝与浓硝酸不反应 |
C | 向10mL0.1mol·L-1FeCl3溶液中加入5mL0.1mol·L-1KSCN溶液,溶液显红色,再滴加少量1mol·L-1KSCN溶液,红色加深 | Fe3+和SCN-的反应是可逆反应 |
D | 向FeCl2溶液中滴加少量的酸性KMnO4溶液,KMnO4溶液褪色 | 氧化性: |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将溴乙烷与氢氧化钠的乙醇溶液共热产生的气体通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 不能说明溴乙烷与氢氧化钠的乙醇溶液共热生成了乙烯 |
| B | 将SO2通入BaCl2溶液中,然后滴加氯水 | 先有白色沉淀生成,滴加氯水后沉淀不溶解 | 先生成BaSO3沉淀,后被氧化为BaSO4 |
| C | 将电石与水反应产生的气体通入溴水 | 溴水褪色 | 生成的乙炔气体中含有H2S |
| D | 用(NH4)2S2O8溶液蚀刻铜制线路板 | 铜制线路板逐渐溶解 | S2O |
①Cl2+KOH→KCl+KClO+KClO3+H2O(未配平);
②2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2O。
下列说法正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向FeCl3溶液中通入足量的H2S | 生成两种沉淀 | Fe3+的氧化性强于S |
| B | 向浓度均为0.1 mol:L-1的CuSO4和MgSO4混合溶液中滴加少量NaOH溶液 | 先出现浅蓝色沉淀 | Cu(OH)2的溶度积比Mg(OH)2的小 |
| C | 向FeCl3溶液中滴入几滴30%的H2O2溶液 | 有气体产生,一段时间后,FeCl3溶液颜色加深 | Fe3+能催化H2O2 分解,且该分解反应为放热反应 |
| D | 铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体 | 加热时无明显现象,加入硝酸钾后溶液变蓝 | 硝酸钾起催化作用 |
①2Cu2++5I-=2CuI↓+I3―; ②I3― + 2S2O32-=S4O62-+ 3I-
反应①中的氧化剂为。现取20.00 mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00 mL,此溶液中Cu2+的浓度为mol·L-1。
H2(g)+ O2(g)=H2O(l)△H2
2As(s)+ O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H=.
298K时,将20mL 3x mol•L﹣1 Na3AsO3、20mL 3x mol•L﹣1 I2和20mL NaOH溶液混合,发生反应:AsO33﹣(aq)+I2(aq)+2OH﹣⇌AsO43﹣(aq)+2I﹣(aq)+H2O(l).溶液中c(AsO43﹣)与反应时间(t)的关系如图所示.

①下列可判断反应达到平衡的是(填标号).
a.溶液的pH不再变化
b.v(I﹣)=2v(AsO33﹣)
c.c (AsO43﹣)/c (AsO33﹣)不再变化
d.c(I﹣)=y mol•L﹣1
②tm时,v正 v逆(填“大于”“小于”或“等于”).
③tm时v逆tn时v逆(填“大于”“小于”或“等于”),理由是.
④若平衡时溶液的pH=14,则该反应的平衡常数K为.

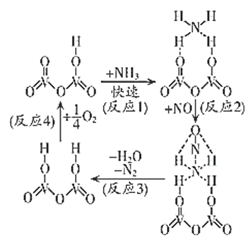
已知:①氧化时鼓入空气使溶液的电位迅速上升;
②四氧化三锰中锰的化合价与四氧化三铁中铁的化合价类似。
回答下列问题:


氧化时N2H4·H2O的作用是
①热还原法
在甲烷气体存在下,将Mn2O3还原成Mn3O4的化学方程式为
②电解法:
利用电解原理,制备四氧化三锰装置如图所示。(电极材料均为惰性电极,<代表电子流向)
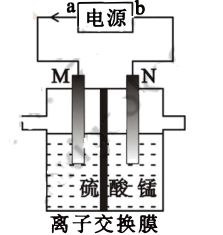
电源正极为(填“a”或“b”),阳极的电极反应式为

已知:
①Al元素及Si元素在水溶液中的主要存在形式与pH的关系为:

②V2O5为两性氧化物:在水溶液中存在:VO+2H+⇌VO
+H2O;钒元素常见的化合价及其在水溶液中的存在形式如下:
价态 | +5 | +4 | +3 | +2 |
存在形式 | VO | VO2+ | V3+ | V2+ |
回答下列问题:
①沉钒率随溶液pH的变化如下图所示。沉钒率随溶液pH值的增加先升高后降低的原因可能是。

②已知25℃时,Kb(NH3·H2O)=1.8×10-5 , Ksp(NH4VO3)=3.0×10-8。若25℃时控制“沉钒”的pH为8.0,当VO恰好完全沉淀时,溶液中的c(NH3·H2O)=mol·L-1。

①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),则滴定终点的现象是。
②晶体中KSCN的质量分数为(保留三位有效数字)

回答下列问题:


完成下列填空:

已知:①2[Mg3Si2O5(OH)4]+9(NH4)2SO43(NH4)2Mg2(SO4)3+12NH3↑+4SiO2+10H2O↑;
②2Fe2MgO4+15(NH4)2SO4 (NH4)2Mg2(SO4)3+16NH3↑+4(NH4)3Fe(SO4)3+8H2O↑
③加热情况下,Fe3+可水解生成一种难溶于水的黄色固体-FeO(OH)
④常温下,NiSO4易溶于水,NiOOH不溶于水。

沉淀物 | Ni(OH)2 | Fe(OH)3 | 黄铵铁矾 |
开始沉淀时的pH | 7.1 | 2.7 | 1.3 |
沉淀完全(c=1×10-5 mol/L)时的pH | 9.2 | 3.7 | 2.3 |

回答下列问题:
温度/℃ | 纯碱中含水量/% | Cl2O的收率/% |
0~10 | 5.44 | 67.85 |
0~10 | 7.88 | 89.26 |
10~20 | 8.00 | 64.24 |
30~40 | 10.25 | 52.63 |
30~40 | 12.50 | 30.38 |
本实验中适宜选用的温度范围和纯碱的含水量分别为、。

已知:(1)P4与碱反应生成相应的次磷酸盐和PH3;(2)具有极强的还原性。
回答下列问题:
I.取a g样品于锥形瓶中,加入稀溶解,水浴加热至75℃。用
的
溶液趁热滴定,消耗
溶液
。
II.向上述溶液中加入适量还原剂将完全还原为
, 加入稀
酸化后,在75℃继续用
溶液滴定,又消耗
溶液
。
若省略步骤II,能否测定的质量分数(若能,写出表达式;若不能,说明原因);若样品中不含
, 则
与
的关系为;若步骤I中滴入
不足,则测得样品中Fe元素含量(填“偏高”、“偏低”或“不变”)。


①加入的质量约为g时,Cu元素恰好完全浸出。
②当时,Se元素浸出率和浸出渣率均增加的原因是。
;
则“沉银”时,溶液中时,可使Ag+沉淀完全[即
]。

①正极的电极反应式为;浸金过程中的催化剂是(填化学式)。
②若有标准状况下11.2L参加反应,浸出金的质量为g。