含钒元素的不同微粒 | VO | VO | V2O | VO |
pH | 4~6 | 6~8 | 8~10 | 10~12 |
另外,V价态不同在溶液中颜色不同,如V2+(紫色)、V3+(绿色)、VO2+(蓝色)、VO(黄色)、VO
(无色)、V5O
(红棕色)等。下列说法正确的是( )


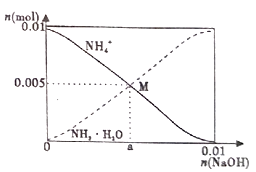
已知:步骤①中,滴加NaOH溶液过程中产生的沉淀会部分溶解。下列说法中正确的是( )
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液肯定不存在的大量离子是( )
选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3+ + 3OH- =Fe(OH)3↓ |
B | K+、ClO-、SO42- | 盐酸 | H++ClO- =HClO |
C | K+、OH-、Cl- | 过量SO2 | SO2+ OH-=HSO3- |
D | H+、Fe2+、 SO42- | Ba(NO3)2溶液 | SO42-+ Ba2+ =BaSO4↓ |
H2O2 + I- = H2O + IO-慢
H2O2 + IO-= H2O + O2 + I- 快
下列说法正确的是( )
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式错误的是( )

下列说法正确的是( )

回答下列问题:

| 成分 | Si | Fe | Cu | Mn | Mg | Zn | Ti | Li | Al |
| 含量 | 0.08 | 0.1 | 2.9~3.5 | 0.5 | 0.25~0.8 | 0.25 | 0.1 | 0.8~1.1 | Bal |
为了使合金具有高耐腐性能,通常先用酸腐蚀除去铝锂合金表面的氧化层,再进行氧化处理,并进行适当封闭,以提高合金表面耐腐蚀性能。仔细阅读上述信息,回答下列问题:


易被氧化。不W 于冷水,微游于乙M。
①连接装置,检查装置气密性,加入药品
②………………………….,A中反应液变浅蓝色后,停止滴入盐酸,向C中通入N2
③打开a,关闭b,保持通入N2 , 再次滴入盐酸
④待C中有大量红色晶体析出,停止滴入盐酸
⑤取C中物质,抽滤,依次用水、乙醇洗涤沉淀,干燥,称重
回答下列问题:
I.在如图所示的三颈烧瓶中加入127g研细的单质I2 和195g30% KOH溶液,搅拌(已知:I2与KOH反应产物之一是KIO3);
II.碘完全反应后,打开分液漏斗中的活塞、弹簧夹,向装置C中通入足量的H2S;
III.反应结束后,向装置C中加入稀H2SO4酸化,水浴加热;
IV.冷却,过滤得KI粗溶液。

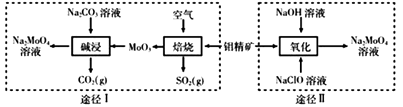
Ⅰ.以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:

已知:
i.纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
ii.NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
iii.NaClO2饱和溶液在温度低于38℃时析出NaClO2∙3H2O,等于或高于38℃时析出NaClO2晶体,高于60℃时分解成NaClO3和NaCl。
a.SO2
b.浓硝酸
c.KMnO4
a.反应①进行过程中应持续鼓入空气
b.反应①后得到的母液中,溶质的主要成分是NaCl
c.反应②中NaOH溶液应过量
d.冷却结晶时温度选择38℃,过滤后进行温水洗涤,然后在低于60℃下进行干燥,得到粗产品NaClO2
在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10−3mol/L。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42− | SO32− | NO3− | NO2− | Cl− |
c /(mol/L) | 8.35×10−4 | 6.87×10−6 | 1.5×10−4 | 1.2×10−5 | 3.4×10−3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式。
②由实验结果可知,脱硫反应速率(填“大于”或“小于”)脱硝反应速率。除SO2和NO在烟气中的初始浓度不同外,还可能存在的原因是。(答出两条即可)
实验序号 | 实验操作 | 实验现象 |
I | 将一束光亮洁净的铁丝伸入到0.1mol/L 的AgNO3溶液中 | 铁丝表面有银白色固体析出,溶液逐渐变为浅绿色 |
II | 取少量实验I中上层清液,滴入K3[Fe(CN) 6]溶液 | 有蓝色沉淀生成 |
实验序号 | 实验操作 | 实验现象 |
III | 取少量实验I中上层清液,滴入少量KSCN溶液,振荡 | 产生白色沉淀,溶液局部变红,振荡后红色消失,沉淀量增加 |
查阅资料:Ag+与SCN-生成白色沉淀AgSCN
乙同学判断有Fe3+ , 理由是 。
实验序号 | 实验操作 | 实验现象 |
IV | 取少量实验I中上层清液,滴加几滴稀盐酸 | 有白色沉淀生成 |
V | 取1mL Fe(NO3)3溶液,滴加2滴等浓度的KSCN溶液,振荡,再滴加少量AgNO3溶液 | 溶液变红;振荡溶液颜色无变化,滴加AgNO3后溶液红色褪去,产生白色沉淀. |
① 实验IV的目的是;
② 用平衡移动原理解释,实验V中溶液红色褪去的原因。

①其中X溶液是;
②由实验得出Ag+和Fe2+反应的离子方程式是;
③ 丙同学的实验设计及结论是否合理,请说明理由。
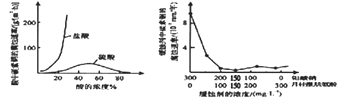
①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1 , 则缓蚀效果最好时钼酸钠(M=206g/mol) 的物质的量浓度为(计算结果保留3位有效数字)。