, 是因为其范德华力更大
B .
, 是因为其范德华力更大
B . 


①具有规则几何外形的固体一定是晶体
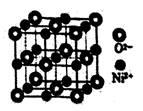
②NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
③非极性分子中一定含有非极性键
④晶格能由大到小: NaF> NaCl> NaBr>NaI
⑤含有共价键的晶体一定具有高的熔、沸点及硬度
⑥s-s σ键与s-p σ键的电子云形状相同
⑦含有π键的化合物与只含σ键的化合物的化学性质不同
⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体


在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
a.x分子的立体构型是,中心原子杂化类型为,属于(填“非极性”或“极性”)分子。
b.X的沸点比水低的主要原因是。
②CuFeS2与氧气反应生成SO2。SO2中心原子的价层电子对数为,共价键的类型有。
③四方晶系CuFeS2的晶胞结构如图所示。

a.Cu+的配位数为,S2-的配位数为。
b.已知:a=b=0.524 nm,c=1.032nm,Na为阿伏加德罗常数的值,CuFeS2晶体的密度是g·cm-3(列出计算式)。
①Fe的基态原子价电子排布式为。
②Ti的基态原子共有种不同能级的电子。
①上述化学方程式中非金属元素电负性由小到大的顺序是(用元素符号表示)。
②CCl4和COCl2分子中所有原子均满足8电子构型,CCl4和COCl2分子中σ键的个数比为,COCl2分子的中心原子的杂化方式为。

①该晶体的化学式为。
②已知该晶胞的摩尔质量为Mg·mol-1 , 密度为dg·cm-3.设NA为阿伏加德罗常数的值,则该晶胞的体积是cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为。(NA可近似取6×1023 ,
=1.7)

可知,O原子的第一电子亲和能为 kJ•mol-1 , FeO晶格能为kJ•mol-1。

(列出计算式即可)
A ④②①③ B ④②③① C ①②④③ D ①④③②
①砷与卤素可形成多种卤化物,AsBr3、AsCl3、AsF3的熔点由低到高的顺序为。砷酸的酸性弱于硒酸,从分子结构的角度解释原因。
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为,画出配离子的结构式(不考虑立体构型)。
①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为。
②铬的晶胞结构如图A所示,它的堆积模型为,在该晶胞中铬原子的配位数为。
③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如图B所示,则碳化钨的化学式为,六棱柱的底边长为a cm,高为b cm,设阿伏加德罗常数的值为NA , 则碳化钨晶体的密度是g·cm-3(列出计算表达式)。

 .
.

①写出与N3-属于等电子体的一种分子(填分子式)。
②氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上





每个晶胞中的碳原子个数为,在下图中画出晶胞沿c轴的投影(用“●”标出碳原子位置即可)。

 )用作该电解液的添加剂。
)用作该电解液的添加剂。 




每个晶胞中含有的 数目为;
填充在
构成的空隙中,每一个空隙由个
构成,空隙的空间形状为。
|
物质 |
MCl2 |
MnS |
MnSO4 |
|
熔点 |
650℃ |
1610℃ |
700℃ |
上表三种物质中晶格能最大的是;上表涉及的三种阴离子中,半径最大的是。

该锰的氧化物的化学式为,该晶体中Mn的配位数为,该晶体中Mn之间的最近距离为pm(用a、b来表示)。

电解法制铝的原料是熔融的Al2O3而不是AlCl3 , 原因是;电解法制镁的原料是熔融的MgCl2而不用MgO,原因是。

 , 它的某种衍生物与
, 它的某种衍生物与 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。①离子化合物 熔点低的原因是。
熔点低的原因是。
②分子中的大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
)。
 中存在大π键,其分子中的大π键可表示为。
中存在大π键,其分子中的大π键可表示为。
③1mol离子化合物 中,阿伏加德罗常数的值为
中,阿伏加德罗常数的值为 , 则根据价电子对互斥(
)理论,空间结构为四面体的原子共有个。
①Ni(CO)4固态时属于晶体(填晶体类型)
②已知CO与N2互为等电子体,则Ni(CO)4中σ键和π键的数目之比为,请事写出一种与CO互为等电子体的阴离子的化学式。