





| 物质 | 熔点/℃ |
| | 800.7 |
| | |
| | |
| | |
与
均为第三周期元素,
熔点明显高于
, 原因是。分析同族元素的氯化物
、
、
熔点变化趋势及其原因。
的空间结构为,其中
的轨道杂化形式为。



①图中压强由小到大的顺序为,判断的依据是。
②进料组成中含有情性气体的图是。
③图3中,当、
时,氮气的转化率
。该温度时,反应
的平衡常数
(化为最简式)。


酞菁分子中所有原子共平面,其中轨道能提供一对电子的
原子是(填图2酞菁中
原子的标号)。钴酞菁分子中,钴离子的化合价为,氮原子提供孤对电子与钴离子形成键。


已知: ,
;
电离常数分别为
、
。
①在弱碱性溶液中,与
反应生成
、
和单质S,其离子方程式为。
②在弱酸性溶液中,反应的平衡常数K的数值为。
③在溶液中,pH越大,
去除水中
的速率越慢,原因是。


①白磷()是分子晶体,易溶于
, 难溶于水,可能原因是。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如下图所示。下列有关黑磷晶体的说法正确的是(填字母序号)。

a.黑磷与白磷互为同分异构体 b.黑磷中磷原子采取杂化
c.黑磷能导电 d.黑磷属于混合型晶体
①实验测定磷化铝和磷化铜的熔点分别为2000℃、1070℃,从结构角度说明其熔点差异的原因。
②磷化硼是一种半导体材料,晶胞结构如图所示,磷化硼的化学式是,已知晶胞边长a pm,阿伏加德罗常数为 , 磷化硼晶体的密度是

软锰矿主要成分 | 杂质 |
MnO2 | MgO、FeO、Fe2O3、Al2O3、SiO2等杂质 |
某科研团队设计制备高纯度MnCO3。反应原理为①MnO2+BaS+H2O=MnO+Ba(OH)2+S;②MnO+H2SO4=MnSO4+H2O;③硫酸锰+碳酸氢铵+一水合氨→MnCO3↓(白色)。工艺流程图如图。
回答下列问题:



①X的化学式为。
②设X的最简式的式量为 , 晶体密度为
, 则X中相邻K之间的最短距离为nm(列出计算式,
为阿伏加德罗常数的值)。


已知:GeO2可溶于强碱溶液,生成锗酸盐;GeCl4的熔点为-49.5℃,沸点为84℃,在水中或酸的稀溶液中易水解。
编号 | 加料量(CaCl2/Ge) | 母液体积(mL) | 过滤后滤液含锗(mg/L) | 过滤后滤液pH | 锗沉淀率(%) |
1 | 10 | 500 | 76 | 8 | 93.67 |
2 | 15 | 500 | 20 | 8 | 98.15 |
3 | 20 | 500 | 2 | 11 | 99.78 |
4 | 25 | 500 | 1.5 | 12 | 99.85 |
①量子化学计算显示含锗化合物H5O2Ge(BH4)3具有良好的光电化学性能。CaPbI3是H5O2Ge(BH4)3的量子化学计算模型,CaPbI3的晶体结构如图所示,若设定图中体心钙离子的分数坐标为( ,
,
),则分数坐标为(0,0,
)的离子是。

②晶体Ge是优良的半导体,可作高频率电流的检波和交流电的整流用。如图为Ge单晶的晶胞,设Ge原子半径为rpm,阿伏加德罗常数的值为NA , 则该锗晶体的密度计算式为(不需化简)ρ=g/cm3。

 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
 )分别以任意比互溶。
)分别以任意比互溶。①二甲基亚砜分子中硫原子的杂化类型为。
②丙酮分子中各原子电负性由大到小的顺序为。
③二甲基亚砜易溶于水,原因可能为。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力

①该晶体中,锰原子周围的硫原子数目为。
②空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别和
, 该晶体中原子的空间利用率为(列出计算式即可)。

a.![]() b.
b.![]()
c.![]() d.
d.![]()
HO-OH | ||
346 | 247 | 207 |
A-A键的键能依次降低的原因是。

①晶胞中氢键的长度(O-H…O的长度)为pm(保留一位小数)。
②普通冰晶体的密度为g·cm⁻³(列出数学表达式,不必计算出结果)。
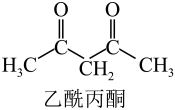

①已知a、b的坐标参数依次为(0,0,0)、( ,
,
),则d的坐标参数为。
②晶胞边长为cpm,该晶体的密度为。(列计算式,设
为阿伏加德罗常数的数值)
 、
、 )的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
)的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。

若金属M的相对原子量Mr,则该晶体的密度为g.cm3。