 B . 金刚石晶体结构模型:
B . 金刚石晶体结构模型: C .
C . 
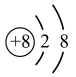
 D . 乙烯的球棍模型:
D . 乙烯的球棍模型:
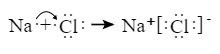 D . 钢铁发生电化学腐蚀的正极反应:
D . 钢铁发生电化学腐蚀的正极反应:  D . 钢铁发生电化学腐蚀的正极反应:Fe-3e-=Fe3+
D . 钢铁发生电化学腐蚀的正极反应:Fe-3e-=Fe3+
 C . 中子数为10的氧元素,其核素符号是
C . 中子数为10的氧元素,其核素符号是 B . 质子数为18、中子数为22的氩原子:
B . 质子数为18、中子数为22的氩原子:A | B | C | D |
| 向稀硫酸中加入
|
| 光照过程中氯水的
|
a时刻稀硫酸与 |
|
|
 B .
B .  C .
C .  B . 质子数为27、中子数为60的Co原子:
B . 质子数为27、中子数为60的Co原子: C . NH4Br的电子式:
C . NH4Br的电子式: D . CCl4分子的比例模型:
D . CCl4分子的比例模型:
 C . 质量数为2的氢原子:
C . 质量数为2的氢原子: 
该电池的正极反应方程式为 ;电池中NaCl溶液的作用是 ;以该电池为电源,用惰性电极电解Na2SO4溶液,当Al电极质量减少1.8g时,电解池阴极生成的气体在标准状况下的体积为L。
①基态Ga原子价电子排布式,核外电子占据最高能级的电子云形状为;基态As原子最高能层上有个电子。
②镓失去电子的逐级电离能(单位:kJ/mol)的数值依次为577、1985、2962、6192,-1由此可推知镓的主要化合价为和+3,砷的第一电离能比镓填“大”或“小”)。
③第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为。
④砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为 ,AsH3分子的空间构型为。
⑤相同压强下,AsH3的沸点NH3(填“大于”或“小于”),原因为。

实验步骤:
①将一定量浓盐酸滴在粉末上,立即产生黄绿色气体。
②待黄绿色气体均匀充满集气瓶时,关闭止水夹。
③再向钠粒滴2滴水,片刻后钠燃烧,产生白烟,白色固体附着在集气瓶内壁上。
回答下列问题:
A.浓溶液 B.浓硫酸 C.澄清石灰水 D.饱和食盐水
此时烧杯中发生反应的离子方程式为:。


A.从上到下,单质颜色越来越深,熔、沸点越来越高
B.单质均可与水发生反应生成两种酸
C.单质均具有强氧化性,能将氧化至
D.氢化物均易溶于水,且均为强酸

A.溶液颜色 B.溶液中氢离子的数目
C.瓶中氧气的体积分数 D.溶液的导电能力
工业上用W2制漂粉精的化学方程式是。
|
元素 |
特征 |
元素 |
特征 |
|
A |
常见金属,其最高价氧化物对应的水化物可以溶于强碱 |
D |
在地壳中含量最多 |
|
B |
常见化肥的主要元素,单质常温下呈气态 |
E |
单质为黄绿色有毒气体 |
|
C |
在短周期主族元素中,原子半径最大 |
F |
原子的核外电子只有1个 |