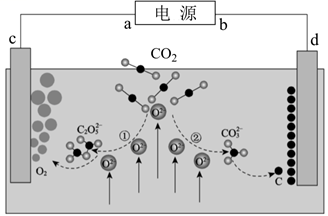
①CuSO4+H2S=CuS↓+H2SO4
②11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓
下列分析错误的是( )







已知:月桂酸 熔点为
;月桂酸和
均难溶于水。该工艺条件下,稀土离子保持
价不变;
的
;
开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
| 离子 | | | | |
| 开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 4.7 | / |
②“操作X”的过程为:先,再固液分离。
①还原 和
熔融盐制备
时,生成
![]() 转移
转移 电子。
② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化
的还原,发生的电极反应为。
②结合电极反应式说明生成溶液a的原理。
电解效率η和选择性S的定义:
η(B)= ×100%
S(B)= ×100%
①若η(EO)=100%,则溶液b的溶质为。
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%,推测η(EO)≈70%的原因:
I.阳极有H2O放电
II.阳极有乙烯放电
III.阳极室流出液中含有Cl2和HClO
……
i.检验电解产物,推测I不成立。需要检验的物质是。
ii.假设没有生成EO的乙烯全部在阳极放电生成CO2 , η(CO2)≈%。经检验阳极放电产物没有CO2。
iii.实验证实推测III成立,所用试剂及现象是。
可选试剂:AgNO3溶液、KI溶液、淀粉溶液、品红溶液。
完成下列填空:
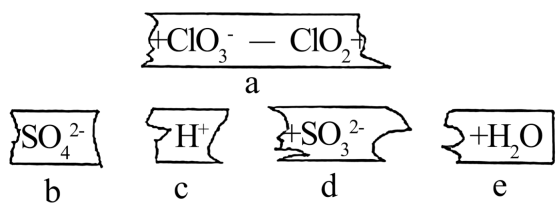
CH3OH+NaClO3+ → CO2↑+ClO2↑+Na2SO4+
a.氧化性:ClO2>NaClO3 b.氧化性:NaClO3>CH3OH
c.还原性:CH3OH>ClO2 d.还原性:CH3OH>Na2SO4
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:H2C2O4 + 2NaClO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2ClO2↑ + 2H2O
完成下列填空:
a.仅做氧化剂 b.既被氧化又被还原
c.发生氧化反应 d.既未被氧化也未被还原
|
氯化物 |
NaCl |
KCl |
CCl4 |
|
熔点/℃ |
804 |
773 |
-22.92 |
试解释表中氯化物熔点差异的原因:。

① 溶液吸收
主要反应的化学方程式为;
②电解的主要目的是,阴极的电极反应式为;
③“高价氮的化合物”中NO2在反应器中发生化合反应的化学方程式为;

①当 大于1.4时,
去除率升高,但
的去除率却降低。其可能的原因是;
② 和
发生的主要反应为
。保持
的初始浓度不变,改变
,将反应后的混合气体通入
乳浊液中吸收。为节省
的用量,又能保持
去除效果,则
合适的值约为;
|
实验序号 |
产品质量/g |
固体Ru质量/g |
|
① |
5.1875 |
2.0210 |
|
② |
5.1875 |
2.0190 |
|
③ |
5.1875 |
2.0200 |
|
④ |
5.1875 |
1.6200 |
则产品的纯度为(用百分数表示)。

A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液

①Na2FeO4中铁元素的化合价为,高铁酸钠用于杀菌消毒时的化学反应类型为 (填“氧化还原反应”、“复分解反应”或“化合反应”)。
②反应2加入饱和KOH溶液可转化析出K2FeO4 , 理由是 。

已知:Cu2O+2H+═Cu+Cu2++H2O